Diethylamin
Diethylamin ist eine chemische Verbindung aus der Gruppe der aliphatischen sekundären Amine.
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
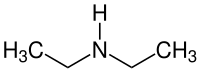
| ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Diethylamin | |||||||||||||||
| Andere Namen |
| |||||||||||||||
| Summenformel | C4H11N | |||||||||||||||
| Kurzbeschreibung |
farblose, leichtentzündliche Flüssigkeit mit aminartigem Geruch[1] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 73,14 g·mol−1 | |||||||||||||||
| Aggregatzustand |
flüssig | |||||||||||||||
| Dichte |
0,71 g·cm−3[1] | |||||||||||||||
| Schmelzpunkt | ||||||||||||||||
| Siedepunkt |
56 °C[1] | |||||||||||||||
| Dampfdruck | ||||||||||||||||
| pKS-Wert | ||||||||||||||||
| Löslichkeit |
vollständig mischbar mit Wasser[1] | |||||||||||||||
| Brechungsindex |
1,3864[4] | |||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| MAK | ||||||||||||||||
| Toxikologische Daten | ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). Brechungsindex: Na-D-Linie, 20 °C | ||||||||||||||||
Gewinnung und Darstellung
BearbeitenDiethylamin kann durch Reaktion von Ethanol mit Ammoniak gewonnen werden, wobei auch Ethylamin und Triethylamin entstehen.
Eigenschaften
BearbeitenDie wässrige Lösung von Diethylamin reagiert stark alkalisch. Ab etwa 500 °C zersetzt sich Diethylamin.[1] Es hat eine dynamische Viskosität von 0,34 mPa·s bei 25 °C.[4]
Sicherheitstechnische Kenndaten
BearbeitenDiethylamin bildet mit Luft leicht entzündliche Dampf-Luft-Gemische. Die Verbindung hat einen Flammpunkt unterhalb von −20 °C.[1] Der Explosionsbereich liegt zwischen 1,7 Vol.‑% (50 g/m3) als untere Explosionsgrenze (UEG) und 10,1 Vol.‑% (305 g/m3) als obere Explosionsgrenze (OEG).[1][7] Die Grenzspaltweite wurde mit 1,15 mm (50 °C) bestimmt.[1] Es resultiert damit eine Zuordnung in die Explosionsgruppe IIA.[1][7] Die Zündtemperatur beträgt 305 °C.[1][7] Der Stoff fällt somit in die Temperaturklasse T2.
Verwendung
BearbeitenDiethylamin wird zur Herstellung von Kautschuk-, Textil-, Flotationschemikalien, von Kunstharzen, Farb- und Arzneistoffen, Insektiziden, galvanischen Bädern und Polymerisationsverzögerern sowie als pH-Wert-Regler und Puffersubstanz verwendet. Es kann auch zur Herstellung des Nervengiftes Tabun verwendet werden[8]. Weiterhin wird es in der Herstellung von Elektrolytkondensatoren eingesetzt.[9]
Supramolekulare Struktur
BearbeitenDiethylamin ist das kleinste und einfachste Molekül das eine supramolekulare Helix als Aggregat mit niedrigster Energie aufweist. Andere ähnlich kleine wasserstoffverbrückte Moleküle bevorzugen zyklische Strukturen.[10]
Verwandte und abgeleitete Verbindungen
Bearbeiten- Diethylaminhydrochlorid (Diethylammoniumchlorid), C4H12ClN
- Diethylaminhydrobromid[11], C4H12BrN
- N,N-Diethylanilin, C10H15N
- N-(Trimethylsilyl)diethylamin, C7H19NSi
- Diethylaminsalicylat[12], C11H17NO3
- Diethylammoniumacetat[13], C6H15NO2
Einzelnachweise
Bearbeiten- ↑ a b c d e f g h i j k l m n o p q r Eintrag zu Diethylamin in der GESTIS-Stoffdatenbank des IFA, abgerufen am 3. Januar 2023. (JavaScript erforderlich)
- ↑ H. K. Hall: Correlation of the Base Strengths of Amines. In: Journal of the American Chemical Society. 79, 1957, S. 5441, doi:10.1021/ja01577a030.
- ↑ Steven Pedersen: Understanding the Principles of Organic Chemistry: A Laboratory Course. Cengage Learning, 2010, ISBN 978-0-495-82993-5, S. 23 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ a b c Datenblatt Diethylamin bei Merck, abgerufen am 21. Januar 2011.
- ↑ Eintrag zu Diethylamine im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 1. Februar 2016. Hersteller bzw. Inverkehrbringer können die harmonisierte Einstufung und Kennzeichnung erweitern.
- ↑ Schweizerische Unfallversicherungsanstalt (Suva): Grenzwerte – Aktuelle MAK- und BAT-Werte, abgerufen am 28. August 2019.
- ↑ a b c Sorbe - Sicherheitstechnische Kenndaten chemischer Stoffe, 131. Ergänzungslieferung 8/2009, ecomed-Verlag.
- ↑ Robert Turkington: Chemicals Used for Illegal Purposes. John Wiley & Sons, 2009, ISBN 978-0-470-18780-7, S. 324 (books.google.de).
- ↑ Daniel Savi, Ueli Kasser, Rolf Widmer: Flüssigkeiten in Kondensatoren - Bestimmung von Flüssigkeiten in elektrischen Kondensatoren mit Definition und Zuordnung von bedenklichen Stoffen - Schlussbericht. In: swico.ch. 6. Mai 2019, S. 48, abgerufen am 14. September 2020.
- ↑ Felix Hanke, Chloe J. Pugh, Ellis F. Kay, Joshua B. Taylor, Stephen M. Todd, Craig M. Robertson, Benjamin J. Slater, Alexander Steiner: The simplest supramolecular helix. In: Chemical Communications. Band 54, 2018, doi:10.1039/C8CC03295E.
- ↑ Externe Identifikatoren von bzw. Datenbank-Links zu Diethylammoniumbromid: CAS-Nr.: 6274-12-0, EG-Nr.: 228-466-2, ECHA-InfoCard: 100.025.879, PubChem: 22665, Wikidata: Q82860734.
- ↑ Externe Identifikatoren von bzw. Datenbank-Links zu Diethylaminsalicylat: CAS-Nr.: 4419-92-5, EG-Nr.: 224-586-4, ECHA-InfoCard: 100.022.353, PubChem: 9837223, ChemSpider: 19278, Wikidata: Q27262917.
- ↑ Externe Identifikatoren von bzw. Datenbank-Links zu Diethylammoniumacetat: CAS-Nr.: 20726-63-0, EG-Nr.: 243-990-1, ECHA-InfoCard: 100.039.976, PubChem: 167925, Wikidata: Q81993222.


