Drosomycin
Drosomycin ist ein antifungales Peptid aus der Fruchtfliege Drosophila melanogaster.
| Drosomycin | ||
|---|---|---|

| ||
| nach PDB 1MYN | ||
| Andere Namen |
Cysteine-rich peptide | |
| Masse/Länge Primärstruktur | 70 Aminosäuren, 7.752 Da | |
| Bezeichner | ||
| Externe IDs | ||
| Vorkommen | ||
| Homologie-Familie | Hovergen | |
| Orthologe (Fruchtfliege) | ||
| Entrez | 38419 | |
| UniProt | P41964 | |
| Refseq (mRNA) | NM_079177.4 | |
| Refseq (Protein) | NP_523901.1 | |
| PubMed-Suche | 38419
| |
Eigenschaften
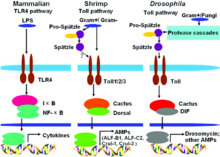
BearbeitenDrosomycin wird im Fettkörper gebildet und in die Hämolymphe sezerniert.[1] Sechs Stunden nach Aktivierung der angeborenen Immunantwort nimmt die Bildung des Drosomycins zu und Drosomycin zirkuliert dann für etwa drei Wochen.[1] In den Larven von D. melanogaster wird Drosomycin in den viszeralen Ästen und den hinteren Spritzlöchern der Tracheen gebildet.[2] Drosomycin besitzt vier Disulfidbrücken.[3] Drosomycin ist teilweise homolog zu einem antifungalen Peptid aus Brassicaceae.[3] Die vier Disulfidbrücken stabilisieren die Proteinstruktur, bestehend aus einer α-Helix und einem β-Faltblatt, die auch in anderen Defensinen von D. melanogaster und einigen pflanzlichen Defensinen vorkommt, beispielsweise ist Drosomycin zu 40 % homolog zum Defensin des Garten-Rettichs.[4] Die Struktur wurde erstmals 1997 aufgeklärt.[5]
Die systemische Genexpression des Drosomycins wird durch Spaetzle induziert,[6] während die Genexpression in den Tracheen durch den Immune Deficiency Pathway (IMD) kontrolliert wird.[7] Das Gen des Drosomycins drs ist 387 bp lang und liegt auf Chromosom 3.[8] Es liegt in einem Gen-Cluster mit sechs anderen Genen (dro1-6) und bildet mit ihnen die drosomycin multigene family unterschiedlicher Funktionen.[9][10] In der verwandten Fliege D. takahashii wurden manche dieser Gene dupliziert und die drosomycin multigene family besitzt dort elf Vertreter.[11] Drosomycin wird in manchen Organen über alle Entwicklungsstadien (Larve, Puppe und erwachsene Fruchtfliege) von D. melanogaster konstitutiv exprimiert.[12]
Neben Drosomycin werden in der Fruchtfliege weitere antimikrobielle Peptide gebildet, wie Cecropine,[13][14] Diptericin,[15] Drosocin,[16] Metchnikowin[17] und Attacin.[18]
Die antifungalen Eigenschaften des Drosomycins bestehen aus einer Lyse von Hyphen, einer Verzögerung des Hyphenwachstums, die in einer vorzeitigen Verzweigung resultiert, und in höheren Konzentrationen wird die Keimung der Sporen gehemmt.[19]
Einzelnachweise
Bearbeiten- ↑ a b S. Uttenweiler-Joseph, M. Moniatte, M. Lagueux, A. Van Dorsselaer, J. A. Hoffmann, P. Bulet: Differential display of peptides induced during the immune response of Drosophila: a matrix-assisted laser desorption ionization time-of-flight mass spectrometry study. In: Proceedings of the National Academy of Sciences. Band 95, Nummer 19, September 1998, S. 11342–11347, PMID 9736738, PMC 21644 (freier Volltext).
- ↑ I. Akhouayri, C. Turc, J. Royet, B. Charroux: Toll-8/Tollo negatively regulates antimicrobial response in the Drosophila respiratory epithelium. In: PLoS pathogens. Band 7, Nummer 10, Oktober 2011, S. e1002319, doi:10.1371/journal.ppat.1002319, PMID 22022271, PMC 3192845 (freier Volltext).
- ↑ a b P. Fehlbaum, P. Bulet, L. Michaut, M. Lagueux, W. F. Broekaert, C. Hetru, J. A. Hoffmann: Insect immunity. Septic injury of Drosophila induces the synthesis of a potent antifungal peptide with sequence homology to plant antifungal peptides. In: Journal of Biological Chemistry. Band 269, Nummer 52, Dezember 1994, S. 33159–33163, PMID 7806546.
- ↑ Franky Fant, Wim Vranken, Willem Broekaert, Frans Borremans: Determination of the three-dimensional solution structure of Raphanus sativus Antifungal Protein 1 by 1H NMR1. In: Journal of Molecular Biology. 279. Jahrgang, Nr. 1, 29. Mai 1998, S. 257–270, doi:10.1006/jmbi.1998.1767 (sciencedirect.com).
- ↑ Céline Landon, Patrick Sodano, Charles Hetru, Jules Hoffmann, Marius Ptak: Solution structure of drosomycin, the first inducible antifungal protein from insects. In: Protein Science. 6. Jahrgang, Nr. 9, 1. September 1997, ISSN 1469-896X, S. 1878–1884, doi:10.1002/pro.5560060908, PMID 9300487, PMC 2143780 (freier Volltext) – (englisch, wiley.com).
- ↑ B. Lemaitre, E. Nicolas, L. Michaut, J. M. Reichhart, J. A. Hoffmann: The dorsoventral regulatory gene cassette spätzle/Toll/cactus controls the potent antifungal response in Drosophila adults. In: Cell. Band 86, Nummer 6, September 1996, S. 973–983, PMID 8808632.
- ↑ Z-T. Zhang, S-Y. Zhu: Drosomycin, an essential component of antifungal defence in Drosophila. In: Insect Molecular Biology. 18. Jahrgang, Nr. 5, 1. Oktober 2009, ISSN 1365-2583, S. 549–556, doi:10.1111/j.1365-2583.2009.00907.x (englisch, wiley.com).
- ↑ Drs Drosomycin [Drosophila melanogaster (fruit fly)] - Gene - NCBI. In: www.ncbi.nlm.nih.gov. Abgerufen am 4. Januar 2017.
- ↑ F. M. Jiggins and K. W. Kim, “The evolution of antifungal peptides in Drosophila,” Genetics, vol. 171, no. 4, pp. 1847– 1859, 2005
- ↑ W. Y. Yang, S. Y. Wen, Y. D. Huang et al., “Functional divergence of six isoforms of antifungal peptide Drosomycin in Drosophila melanogaster,” Gene, vol. 379, pp. 26–32, 2006
- ↑ Bin Gao, Shunyi Zhu: The drosomycin multigene family: three-disulfide variants from Drosophila takahashii possess antibacterial activity. In: Scientific Reports. 6, 2016, doi:10.1038/srep32175.
- ↑ D. Ferrandon, A. C. Jung, M. Criqui, B. Lemaitre, S. Uttenweiler-Joseph, L. Michaut, J. Reichhart, J. A. Hoffmann: A drosomycin-GFP reporter transgene reveals a local immune response in Drosophila that is not dependent on the Toll pathway. In: The EMBO Journal. 17. Jahrgang, Nr. 5, 10. August 1998, ISSN 0261-4189, S. 1217–1227, doi:10.1093/emboj/17.5.1217, PMID 9482719, PMC 1170470 (freier Volltext).
- ↑ P. Kylsten, C. Samakovlis, D. Hultmark: The cecropin locus in Drosophila; a compact gene cluster involved in the response to infection. In: The EMBO Journal. 9. Jahrgang, Nr. 1, 1. Januar 1990, ISSN 0261-4189, S. 217–224, PMID 2104802, PMC 551649 (freier Volltext).
- ↑ Y. Tryselius, C. Samakovlis, D. A. Kimbrell, D. Hultmark: CecC, a cecropin gene expressed during metamorphosis in Drosophila pupae. In: European Journal of Biochemistry. 204. Jahrgang, Nr. 1, 15. Februar 1992, ISSN 0014-2956, S. 395–399, PMID 1740152.
- ↑ C. Wicker, J. M. Reichhart, D. Hoffmann, D. Hultmark, C. Samakovlis, J. A. Hoffmann: Insect immunity. Characterization of a Drosophila cDNA encoding a novel member of the diptericin family of immune peptides. In: Journal of Biological Chemistry. 265. Jahrgang, Nr. 36, 25. Dezember 1990, ISSN 0021-9258, S. 22493–22498, PMID 2125051 (englisch, jbc.org).
- ↑ P. Bulet, J. L. Dimarcq, C. Hetru, M. Lagueux, M. Charlet, G. Hegy, A. Van Dorsselaer, J. A. Hoffmann: A novel inducible antibacterial peptide of Drosophila carries an O-glycosylated substitution. In: Journal of Biological Chemistry. 268. Jahrgang, Nr. 20, 15. Juli 1993, ISSN 0021-9258, S. 14893–14897, PMID 8325867 (englisch, jbc.org).
- ↑ E. A. Levashina, S. Ohresser, P. Bulet, J. M. Reichhart, C. Hetru, J. A. Hoffmann: Metchnikowin, a novel immune-inducible proline-rich peptide from Drosophila with antibacterial and antifungal properties. In: European Journal of Biochemistry. 233. Jahrgang, Nr. 2, 15. Oktober 1995, ISSN 0014-2956, S. 694–700, PMID 7588819.
- ↑ B. Asling, M. S. Dushay, D. Hultmark: Identification of early genes in the Drosophila immune response by PCR-based differential display: the Attacin A gene and the evolution of attacin-like proteins. In: Insect Biochemistry and Molecular Biology. 25. Jahrgang, Nr. 4, 1. April 1995, ISSN 0965-1748, S. 511–518, PMID 7742836.
- ↑ Phillipe Bulet, Charles Hetru, Jean-Luc Dimarcq, Daniéle Hoffmann: Antimicrobial peptides in insects; structure and function. In: Developmental & Comparative Immunology. 23. Jahrgang, Nr. 4–5, 1. Juni 1999, S. 329–344, doi:10.1016/S0145-305X(99)00015-4 (sciencedirect.com).