Dysprosium(III)-oxid
Dysprosium(III)-oxid ist eine chemische Verbindung aus der Gruppe der Oxide.
| Kristallstruktur | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
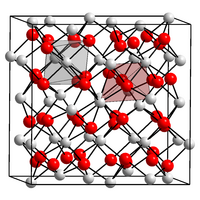
| ||||||||||||||||
| _ Dy3+ _ O2− | ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Dysprosium(III)-oxid | |||||||||||||||
| Andere Namen |
Dysprosia | |||||||||||||||
| Verhältnisformel | Dy2O3 | |||||||||||||||
| Kurzbeschreibung |
weißes, leicht hygroskopisches Pulver[1] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 373,00 g·mol−1 | |||||||||||||||
| Aggregatzustand |
fest[2] | |||||||||||||||
| Dichte |
7,81 g·cm−3 (25 °C)[2] | |||||||||||||||
| Schmelzpunkt | ||||||||||||||||
| Siedepunkt |
3900 °C[3] | |||||||||||||||
| Löslichkeit | ||||||||||||||||
| Brechungsindex |
1,9757[5] | |||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Toxikologische Daten | ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). Brechungsindex: Na-D-Linie, 20 °C | ||||||||||||||||
Geschichte
BearbeitenIm Jahr 1878 wurden Erbiumerze entdeckt, die neben diesem auch Holmium- und Thulium(III)-oxid enthielten. Der französische Chemiker Paul Émile Lecoq de Boisbaudran konnte während der Arbeit mit Holmium(III)-oxid im Jahre 1886 in Paris noch Dysprosium(III)-oxid isolieren und entdeckte damit das Element Dysprosium.[6]
Gewinnung und Darstellung
BearbeitenDysprosium(III)-oxid kann durch Verbrennung von Dysprosium an Luft gewonnen werden.[7]
Eigenschaften
BearbeitenDysprosium(III)-oxid ist ein weißes, leicht hygroskopisches Pulver[1], das unlöslich in Wasser[4] und stark magnetisch[7] ist. Es besitzt eine kubische Kristallstruktur.[8] Es reagiert mit Säuren unter Kationenbildung, welche ihrerseits in Wasser schwach sauer reagieren.[9]
Verwendung
BearbeitenDysprosium(III)-oxid wird für spezielle Zwecke in Glas, Leuchtstoffen, Lasern und Halogen-Metalldampflampen eingesetzt. Es wird weiterhin in Cermets für Kernreaktor-Steuerstäbe verwendet.[1] Als Dotierungsmittel für Bariumtitanatoxid-Kondensatoren wird es für kleine Kondensatoren hoher Kapazität eingesetzt.[10] Aufgrund seiner magnetischen Eigenschaften ist es für Motoren und Generatoren interessant.[11]
Einzelnachweise
Bearbeiten- ↑ a b c d Reade: Dysprosiumoxid (Seite nicht mehr abrufbar, festgestellt im April 2018. Suche in Webarchiven)
- ↑ a b c d e Datenblatt Dysprosium(III) oxide, ≥99.99% trace metals basis bei Sigma-Aldrich, abgerufen am 1. März 2012 (PDF).
- ↑ a b David R. Lide: CRC Handbook of Chemistry and Physics, 87th Edition. 2006, ISBN 978-0-8493-0487-3, S. 4–63.
- ↑ a b Datenblatt Dysprosiumoxid bei Merck, abgerufen am 1. März 2012.
- ↑ David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press / Taylor and Francis, Boca Raton FL, Index of Refraction of Inorganic Crystals, S. 10-246.
- ↑ Paul Émile Lecoq de Boisbaudran: L'holmine (ou terre X de M Soret) contient au moins deux radicaux métallique (Holminia contains at least two metal). In: Comptes Rendus. 143. Jahrgang, 1886, S. 1003–1006 (französisch, bnf.fr).
- ↑ a b Robert E. Krebs: "Dysprosium". The History and Use of our Earth's Chemical Elements. Greenwood Press, 1998, ISBN 0-313-30123-9, S. 234–235.
- ↑ G. Adachi, Nobuhito Imanaka und Z.C. Kang: Binary rare earth oxides. Springer Netherlands, 2004, ISBN 978-1-4020-2568-6 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ Periodensystem der Elemente online: Säure-Base-Verhalten: Dysprosium
- ↑ John Emsley: Nature's building blocks: an A-Z guide to the elements. Oxford University Press, 2003, ISBN 978-0-19-850340-8, S. 131 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ Steven Chu: Critical Materials Strategy. Diane Publishing Books, 2010, ISBN 978-1-4379-4418-1, S. 77 (eingeschränkte Vorschau in der Google-Buchsuche).