Epsilonblau
Epsilonblau ist eine chemische Verbindung aus der Gruppe der Azofarbstoffe. Die Farbe einer wässrigen Lösung ist pH-abhängig; daher wird Epsilonblau als Säure-Base-Indikator verwendet. Die Farbe schlägt im pH-Bereich von 11,6–13,0 von orange nach violett um.[3]
| Strukturformel | |||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
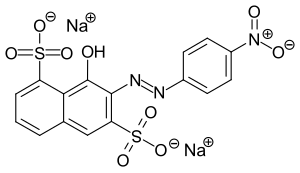
| |||||||||||||
| Allgemeines | |||||||||||||
| Name | Epsilonblau | ||||||||||||
| Andere Namen |
Dinatrium-8-Hydroxy-7-[(4-nitrophenyl)azo]naphthalin-1,6-disulfonat | ||||||||||||
| Summenformel | C16H9N3O9S2Na2 | ||||||||||||
| Kurzbeschreibung |
blauer bis violetter Feststoff[1] | ||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||
| |||||||||||||
| Eigenschaften | |||||||||||||
| Molare Masse | 497,36 g·mol−1 | ||||||||||||
| Aggregatzustand |
fest[1] | ||||||||||||
| Sicherheitshinweise | |||||||||||||
| |||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | |||||||||||||
Synthese
BearbeitenDie Darstellung von Epsilonblau erfolgt durch Diazotierung von p-Nitroanilin mit Natriumnitrit und Salzsäure und Kupplung des Diazoniumsalzes mit 8-Hydroxynaphthalin-1,6-disulfonsäure (Trivialname ε-Säure) und Natriumcarbonat.[4]
Verwendung
BearbeitenAls Indikator im pH-Bereich 12–13 ist Epsilonblau zur Bestimmung der Kohlendioxidsättigung von Kalilauge und für die Analyse von Hypobromit-Lösungen geeignet.[5][6]
Einzelnachweise
Bearbeiten- ↑ a b Otto Chemie Pvt. Ltd.: Epsilon blue, indicator 84540-31-8 - Manufacturers & Suppliers in India with worldwide shipping, abgerufen am 20. Februar 2022.
- ↑ Dieser Stoff wurde in Bezug auf seine Gefährlichkeit entweder noch nicht eingestuft oder eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- ↑ Strukturformeln von Farbindikatoren – Epsilonblau in der ChemgaPedia ( vom 9. Mai 2021 im Internet Archive)
- ↑ K.H. Ferber: Indicator Properties of Derivatives of 4'-Nitrophenylazo-1-naphtol. In: Industrial & Engineering Chemistry Analytical Edition. Band 18, Nr. 10, 1946, S. 631–632, doi:10.1021/i560158a015.
- ↑ E. Winter: Indicator für die Kohlendioxydsättigung von Kalilauge. In: Fresenius’ Zeitschrift für Analytische Chemie, Jg. 1957, Bd. 156, Heft 4, S. 281–283, doi:10.1007/bf00448349.
- ↑ N. Velghe, A. Claeys: Analysis of hypobromite solutions by indicator titrations. In: Analytica Chimica Acta, Jg. 1972, Bd. 60, Heft 2, S. 377–383, doi:10.1016/S0003-2670(01)95014-7.