Essigsäureallylester
Essigsäureallylester, auch Allylacetat genannt, ist eine organisch-chemische Verbindung aus der Stoffgruppe der Carbonsäureester, genauer der Essigsäureester.
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
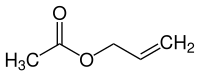
| |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Essigsäureallylester | ||||||||||||||||||
| Andere Namen |
| ||||||||||||||||||
| Summenformel | C5H8O2 | ||||||||||||||||||
| Kurzbeschreibung |
farblose Flüssigkeit mit aromatischem, rumähnlichen Geruch[1] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 100,12 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
flüssig[1] | ||||||||||||||||||
| Dichte |
0,93 g·cm−3 (20 °C)[1] | ||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Siedepunkt |
103 °C[1] | ||||||||||||||||||
| Dampfdruck | |||||||||||||||||||
| Löslichkeit |
wenig löslich in Wasser (20 g·l−1 bei 25 °C)[1] | ||||||||||||||||||
| Brechungsindex |
1,4050 (20 °C)[2] | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Toxikologische Daten | |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). Brechungsindex: Na-D-Linie, 20 °C | |||||||||||||||||||
Gewinnung und Darstellung
BearbeitenDie großtechnische Herstellung von Allylacetat erfolgt praktisch ausschließlich durch die Acetoxylierung von Propen mit Essigsäure und Sauerstoff bei Temperaturen von 150–250 °C und einem Druck von 6–10 bar an Palladium-Katalysatoren in der Gasphase:[2][4]
Um die enorme molare Reaktionsenthalpie (ΔHR= −1890 kJ·mol−1) dieser exothermen Reaktion abzuführen, verwendet man Rohrbündelreaktoren, welche mit Druckwasser gekühlt werden. Das Katalysatorsystem besteht aus metallischem Palladium oder Palladium-Verbindungen, welche auf einem inerten Trägermaterial (meist Siliciumdioxid und Aluminiumoxid) sind. Das Palladium ist meist noch mit Promotoren wie Alkalimetallacetaten (häufig Kaliumacetat) und weiteren Metallen oder Verbindungen davon (z. B. Eisen, Bismut, Kupfer) dotiert. Bei diesem Prozess können Selektivitäten von bis zu 90 % erreicht werden. Als einziges Nebenprodukt wird – neben Wasser – Kohlenstoffdioxid gebildet.[2][4]
Eigenschaften
BearbeitenPhysikalische Eigenschaften
BearbeitenEssigsäureallylester hat eine Dichte von 0,93 g/cm3 bei 20 °C. Die relative Gasdichte (Dichteverhältnis zu trockener Luft bei gleicher Temperatur und gleichem Druck) beträgt 3,45 und die relative Dichte des Dampf-Luft-Gemisches 1,33 (Dichteverhältnis zu trockener Luft bei 20 °C und Normaldruck). Die dynamische Viskosität beträgt 0,52 mPa·s bei 20 °C. Der Octanol-Wasser-Verteilungskoeffizient liegt bei 0,97.[1]
Chemische Eigenschaften
BearbeitenAllylacetat ist eine leicht entzündbare Flüssigkeit aus der Stoffgruppe der Carbonsäureester. Zudem ist es wenig löslich in Wasser (20 g/l bei 25 °C). Durch thermische Einwirkung auf den Stoff zersetzt sich dieser unter Umständen heftig. Essigsäureallylester neigt aufgrund seiner reaktiven Doppelbindung zur spontanen Polymerisation. Weiterhin ist es elektrostatisch aufladbar.[1]
Verwendung
BearbeitenAllylacetat wird zur Herstellung von anderen chemischen Verbindungen benutzt. So kann z. B. durch säurekatalysierte Hydrolyse von Essigsäureallylester Allylalkohol gewonnen werden. Durch Oxidation mit Essigsäure und Sauerstoff an Palladium-Katalysatoren kann Allylidendiacetat hergestellt werden. Die Umsetzung von Allylacetat mit Salzsäure liefert in guten Ausbeuten Allylchlorid, die Reaktion mit Blausäure hingegen liefert Allylcyanid. 4-Acetoxybutyraldehyd kann durch Hydroformylierung von Allylacetat in 70%iger Ausbeute gewonnen werden.[2]
Sicherheitshinweise
BearbeitenDie Dämpfe von Essigsäureallylester können mit Luft explosive Gemische bilden. Die Verbindung lädt sich statisch leicht auf. Die Entzündung kann bereits durch einen Funken statischer Elektrizität von verhältnismäßig geringer Energie erfolgen. Essigsäureallylester wird hauptsächlich durch den Atemtrakt aufgenommen, eine Resorption über die Haut wird ebenfalls vermutet. Bei Aufnahme oder Verschlucken kann es akut zu Reizwirkungen auf Augen, Atemwege und Haut kommen. Chronisch besteht das Potential zur lokalen Schädigung kontaktierter Gewebe. In Tierversuchen zeigte sich eine Schädigung von Leber und Blutbildung. Zur Reproduktionstoxizität und Kanzerogenität liegen bisher keine ausreichenden Angaben vor. In Tierversuchen mit Ratten wurde keine genotoxische Wirkung festgestellt. Essigsäureallylester weist eine untere Explosionsgrenze (UEG) von 1,7 Vol.-% (70 g/cm3) und eine obere Explosionsgrenze (OEG) von ca. 10,1 Vol.-% (ca. 420 g/cm3) auf. Die Grenzspaltweite wurde auf 0,96 mm bestimmt. Die Zündtemperatur beträgt 375 °C. Der Stoff fällt somit in die Temperaturklasse T2 und die Explosionsgruppe IIA. Mit einem Flammpunkt von 11 °C gilt die Flüssigkeit als leicht entzündbar.[1]
Weblinks
BearbeitenEinzelnachweise
Bearbeiten- ↑ a b c d e f g h i j k l m n o p Eintrag zu Allylacetat in der GESTIS-Stoffdatenbank des IFA, abgerufen am 3. Januar 2023. (JavaScript erforderlich)
- ↑ a b c d Ludger Krähling, Jürgen Krey, Gerald Jakobson, Johann Grolig, Leopold Miksche: Allyl Compounds. In: Ullmann’s Encyclopedia of Industrial Chemistry. Wiley-VCH, 15. Juni 2000, doi:10.1002/14356007.a01_425.
- ↑ Eintrag zu Allyl acetate im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 28. Dezember 2020. Hersteller bzw. Inverkehrbringer können die harmonisierte Einstufung und Kennzeichnung erweitern.
- ↑ a b Patent CN103121957B: Method for preparing 2-propenyl ethanoate by using propylene gas phase oxidation method. Veröffentlicht am 8. Juli 2015, Anmelder: China Petroleum & Chemical Corporation (SINPOEC), Erfinder: Yang Yunxin, Zhang Libin.

