Ethylsulfat
Ethylsulfat ist eine organische Verbindung, die als Zwischenprodukt bei der Herstellung von Ethanol aus Ethylen entsteht.
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
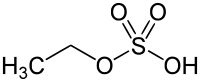
| |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Ethylsulfat | ||||||||||||||||||
| Andere Namen |
| ||||||||||||||||||
| Summenformel | C2H6O4S | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 126,13 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
flüssig[1] | ||||||||||||||||||
| Dichte |
1,3657 g·cm−3[2] | ||||||||||||||||||
| Siedepunkt |
280 °C (Zersetzung)[2] | ||||||||||||||||||
| Löslichkeit |
leicht löslich in Wasser[2] | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | |||||||||||||||||||
Geschichte
BearbeitenEthylsulfat wurde zeitgleich mit dem Ether 1730 von August Siegmund Frobenius entdeckt,[4] und von dem französischen Chemiker Antoine François de Fourcroy 1797 und Joseph Louis Gay-Lussac 1815 genauer untersucht.[5][6] Der Genfer Naturforscher Nicolas Théodore de Saussure untersuchte es ebenfalls 1807.[7] 1827 entdeckte der Franzose Félix-Polydore Boullay zusammen mit Jean-Baptiste Dumas die Rolle von Ethylsulfat in der Herstellung von Diethylether aus Schwefelsäure und Ethanol.[8][9]
Verwendung
BearbeitenEthanol wurde früher primär durch die Umsetzung von Ethylen mit Schwefelsäure zu Ethylsulfat, welches anschließend zu Ethanol hydrolysiert wurde, hergestellt.[10] Die Methode wurde jedoch zunehmend durch die direkte Hydration von Ethylen ersetzt.[11]
Gewinnung und Darstellung
BearbeitenEthylsulaft kann im Labor durch die Reaktion von Schwefelsäure mit Ethanol hergestellt werden, die Temperatur darf dabei 140 °C nicht überschreiten:
Bei Temperaturen über 140 °C zersetzt sich das entstehende Ethylsulfat zu Diethylether und Schwefelsäure.[12][13]
In wässriger Lösung wird Ethylsulfat durch die langsame Hydrolyse von Diethylsulfat gebildet.[14]
Eigenschaften
BearbeitenEthylsulfat kann Salze bilden, z. B. Natriumethylsulfat[S 1]. Diese können durch die Reaktion mit einen Carbonat dargestellt werden. So reagiert es mit Kaliumcarbonat zu Kaliumhydrogencarbonat und Kaliumethylsulfat[S 2].[13]
Ethylsulfat ist ein direkter Metabolit von Ethanol, der sich bei chronischem Alkoholkonsum im Haar anreichert und daher ein verlässlicher Biomarker für den Nachweis des Konsums ist.[15]
Einzelnachweise
Bearbeiten- ↑ Charles J. Baker: Fire Fighter's Handbook of Hazardous Materials. Jones & Bartlett Learning, 2005, ISBN 978-0-7637-3408-4, S. 210.
- ↑ a b c CRC Handbook of Chemistry and Physics. 95. Auflage. CRC Press, 2014, S. 268.
- ↑ a b Sicherheitsdatenblatt Methyl sulfate. AmBeed, 23. Oktober 2023, abgerufen am 16. November 2024.
- ↑ Joannes Sigismundus Augustus Frobenius: An account of a spiritus vini æthereus, together with several experiments tried therewith. In: Philosophical Transactions of the Royal Society of London. Nr. 413, 1730, S. 283–289, doi:10.1098/rstl.1729.0045 (englisch).
- ↑ Fourcroy, A.F. and Vauquelin, L.N.: Sur l'action de l'acide sulfurique sur l'alcool et de la formation de l'éther. Hrsg.: Annales de Chimie. 1797, S. 203–215 (französisch).
- ↑ Gay-Lussac, L.J.: Sur l'analyse de l'alcool et de l'éther sulfurique et sur les produits de la fermentation. In: Annales de Chimie. 1815, S. 311–318 (französisch).
- ↑ Théodore de Saussure: Mémoire sur la composition de l'alcohol et de l'éther sulfurique. In: Journal de physique, de chimie, d'histoire naturelle et des arts. 1807, S. 316–354 (französisch).
- ↑ Dumas, J-B and Boullay, P.: Mémoire sur la formation de l'éther sulfurique. In: Annales de Chimie et de Physique. 1827, S. 294–316.
- ↑ Jaime Wisniak: Félix-Polydore Boullay. In: Revista CENIC Ciencias Químicas. Nr. 1, 2010, S. 59–66.
- ↑ Frank C. Whitmore: Organic Chemistry. In: Courier Corporation. 2012, ISBN 978-0-486-31115-9 (englisch).
- ↑ Ralph Landau, G. S Schaffel: Origin and Refining of Petroleum. In: Recent Developments in Ethylene Chemistry. Band 103, 1971, ISBN 978-0-8412-0120-0, S. 150–157, doi:10.1021/ba-1971-0103.ch008 (englisch).
- ↑ Julius B. Cohen: Practical Organic Chemistry (preparation 5). 1930 (englisch).
- ↑ a b Frederick George Mann and Bernard Charles Saunders: Practical Organic Chemistry (Preparations, The Interaction of Ethanol and Sulfuric acid). In: Longman Inc. 1960 (englisch).
- ↑ IARC Working Group on the Evaluation of Carcinogenic Risks to Humans: DIETHYL SULFATE. In: Occupational Exposures to Mists and Vapours from Strong Inorganic Acids; and Other Industrial Chemicals. International Agency for Research on Cancer, 1992, PMID 1345374 (nih.gov).
- ↑ Delphine Cappelle, Foon Yin Lai, Adrian Covaci, Annemie Vermassen, Cleo L. Crunelle, Hugo Neels, Alexander L.N. Van Nuijs: Assessment of ethyl sulphate in hair as a marker for alcohol consumption using liquid chromatography-tandem mass spectrometry. In: Drug Testing and Analysis. Nr. 10, 2018, S. 1566–1572, doi:10.1002/dta.2410, PMID 29923331 (englisch).
Anmerkungen
Bearbeiten- ↑ Externe Identifikatoren von bzw. Datenbank-Links zu Natriumethylsulfat: CAS-Nr.: 546-74-7, EG-Nr.: 208-910-1, ECHA-InfoCard: 100.008.101, GESTIS: 24040, PubChem: 23680278, ChemSpider: 61643, Wikidata: Q27277131.
- ↑ Externe Identifikatoren von bzw. Datenbank-Links zu Kaliumethylsulfat: CAS-Nr.: 563-17-7, EG-Nr.: 209-244-4, ECHA-InfoCard: 100.008.405, PubChem: 23680282, ChemSpider: 61705, Wikidata: Q81989079.
