Eu(tfc)3
Eu(tfc)3 (ehemals Eu(facam)3) ist eine enantiomerenreine organische Verbindung des Europiums, welches als gelb-oranges Pulver erscheint.[1]
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| |||||||||||||||||||
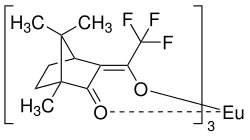
| Strukturformel des (+)-Enantiomers des Eu(tfc)3 | |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Eu(tfc)3 | ||||||||||||||||||
| Andere Namen |
| ||||||||||||||||||
| Summenformel | C36H42EuF9O6 | ||||||||||||||||||
| Kurzbeschreibung |
gelb-oranges Pulver[1] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 893,66 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
fest | ||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | |||||||||||||||||||
Verwendung
BearbeitenEu(tfc)3 wird vor allem in der NMR-Spektroskopie eingesetzt. Da es selbst enantiomerenrein ist, kann es diastereomere Aggregate mit anderen Stoffen bilden. So können im NMR, indirekt über das Diastereomerenverhältnis, Enantiomerenverhältnisse aufgeklärt werden. Außerdem kann es zur Bestimmung der absoluten Konfiguration von Alkoholen benutzt werden.[2]
Struktur und Eigenschaften
BearbeitenEs existieren beide Enantiomere des Eu(tfc)3, die sich entsprechend vom (+)- oder (−)-Campher ableiten. Viele Studien untersuchen jedoch nur das (+)-Enantiomer.[3][2] Die Gründe für die Verwendung von (+)-Campher sind vielfältig. So zeichnet sich die enantiomerenrein vorkommende Verbindung durch hohe Verfügbarkeit, Kristallinität und eine Vielzahl an möglichen Transformationen aus, die es erlauben, chirale Liganden herzustellen.[4]
Eu(tfc)3 ist strukturell eng mit Eu(hfc)3 verwandt und unterscheidet sich nur in der Länge des perfluorierten Rests am Campher-Grundgerüst. Die kürzere Kette im tfc-Liganden führt zu einer schlechteren Aufspaltung der Signale in NMR-Spektren.[3] Es ist löslich in Chloroform, aber unlöslich in Wasser.[5] Wie die meisten Lanthanoid-Shift-Reagenzien ist die Verbindung hygroskopisch.
Sicherheitshinweise
BearbeitenStarke Oxidationsmittel können starke Reaktionen mit Eu(tfc)3 hervorrufen. Fluorwasserstoff, Kohlenstoffmonoxid sowie Kohlenstoffdioxid und Europiumoxide sind die Zersetzungsprodukte der Verbindung.[1]
Einzelnachweise
Bearbeiten- ↑ a b c d e Datenblatt Tris(trifluoromethylhydroxymethylene-d-camphorato)europium(III) bei Alfa Aesar, abgerufen am 11. Februar 2020 (Seite nicht mehr abrufbar).
- ↑ a b Indranath Ghosh, Hongbo Zeng, Yoshito Kishi: Application of Chiral Lanthanide Shift Reagents for Assignment of Absolute Configuration of Alcohols. In: Organic Letters. Band 6, Nr. 25, Dezember 2004, S. 4715–4718, doi:10.1021/ol048061f.
- ↑ a b Mariane Axt, João Alifantes, Valentim Emílio Uberti Costa: Use of chiral lanthanide shift reagents in the elucidation of NMR signals from enantiomeric mixtures of polycyclic compounds. In: Journal of the Chemical Society Perkin Transactions 2. Band 0, Nr. 12, 1999, S. 2783–2788, doi:10.1039/A904473F.
- ↑ W. Oppolzer: Camphor as a natural source of chirality in asymmetric synthesis. In: Pure and Applied Chemistry. Band 62, Nr. 7, 1. Januar 1990, S. 1241–1250, doi:10.1351/pac199062071241 (degruyter.com [abgerufen am 13. Februar 2020]).
- ↑ Europium tris(3-(trifluoromethylhydroxymethylene)-(+)-camphorate) | CAS 34830-11-0. Abgerufen am 11. Februar 2020.