Insulin
Insulin (andere Namen: Insulinum, Insulinhormon, Inselhormon) ist ein für alle Wirbeltiere lebenswichtiges Proteohormon (Polypeptidhormon), das in den β-Zellen der Bauchspeicheldrüse gebildet wird. Diese spezialisierten Zellen befinden sich in den Langerhans-Inseln. Von diesen „Inseln“ leitet sich auch der Name „Insulin“ ab (von lateinisch insula „Insel“). Das seit 1921 bekannte Insulin ist an der Regulation des Stoffwechsels, insbesondere dem der Kohlenhydrate, beteiligt. Insulin senkt den Blutzuckerspiegel, indem es Körperzellen dazu anregt, Glucose aus dem Blut aufzunehmen.
| Insulin | ||
|---|---|---|
| ||
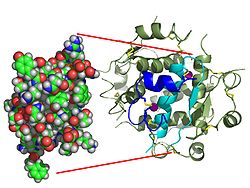
| Zwei Modelldarstellungen des Insulinmoleküls. Links das einfache Molekül (Monomer) als ein Kalottenmodell, aus dem die Oberflächenform hervorgeht. Rechts das sechsfache Molekül (Hexamer) als so genanntes Bändermodell, bei dem die innere Struktur deutlich wird. Bei letzterem sind α-Helices durch Schrauben und β-Faltblätter durch Pfeile dargestellt. | ||
|
Vorhandene Strukturdaten: 1ai0, 3ins, 4ins, 6ins, 7ins, 9ins | ||
| Eigenschaften des menschlichen Proteins | ||
| Masse/Länge Primärstruktur | 5,8 kDa[1] / 51 Aminosäuren | |
| Sekundär- bis Quartärstruktur | Heterodimer (21 + 30 aa) | |
| Präkursor | Proinsulin | |
| Bezeichner | ||
| Gen-Name | INS | |
| Externe IDs | ||
| Arzneistoffangaben | ||
| ATC-Code | A10AB01 | |
| DrugBank | DB00030 | |
| Vorkommen | ||
| Homologie-Familie | CLU_140421_1_0 | |
| Übergeordnetes Taxon | Wirbeltiere | |
| Orthologe | ||
| Mensch | Maus | |
| Entrez | 3630 | 16334 |
| Ensembl | ENSG00000129965 | ENSMUSG00000000215 |
| UniProt | P01308 | Q5EEX1 |
| Refseq (mRNA) | NM_000207 | NM_008387 |
| Refseq (Protein) | NP_000198 | NP_032413 |
| Genlocus | Chr 11: 2.14 – 2.14 Mb | Chr 7: 142.49 – 142.49 Mb |
| PubMed-Suche | 3630 | 16334
|
Funktion und Wirkung
BearbeitenDie Regulation der Konzentration von Glucose im Blut erfolgt durch einen Regelkreis aus zwei Hormonen, die abhängig von der Blutzuckerkonzentration ausgeschüttet werden. Insulin ist das einzige Hormon, das den Blutzuckerspiegel senken kann. Sein Gegenspieler ist das Glucagon, dessen Hauptaufgabe es ist, den Blutzuckerspiegel zu erhöhen. Auch Adrenalin, Kortisol und Schilddrüsenhormone haben blutzuckersteigernde Wirkungen.
Der Blutzuckerspiegel steigt vor allem nach der Aufnahme von kohlenhydratreicher Nahrung. Als Reaktion darauf wird von den β-Zellen Insulin ins Blut ausgeschüttet. Insulin senkt den Blutzuckerspiegel dadurch, dass es mittels seiner „Schlüsselfunktion“ der Glucose aus dem Blutplasma und der Gewebsflüssigkeit den Durchtritt durch die Zellmembran in das Zellinnere ermöglicht. Vor allem die Leber- und Muskelzellen können in kurzer Zeit große Mengen Glucose aufnehmen und sie in Form von Glycogen speichern oder zur Energiegewinnung abbauen (siehe Glycolyse).
Auch auf andere Zellen wirkt das Hormon, so hat es Einfluss auf den Fett- und Aminosäurestoffwechsel sowie auf den Kaliumhaushalt.
Das Hormon ist wesentlicher Faktor folgender Erkrankungen:
Das im Blut zirkulierende Insulin entfaltet seine Wirkung durch Bindung an Insulinrezeptoren.
Insulinrezeptor
BearbeitenLetztlich löst die Bindung dieses Hormons an seinen Rezeptor eine Reihe von Kinase-Kaskaden (Kaskade von Phosphorylierungsreaktionen) aus, die durch Signalwege beschrieben werden können.[2]
Diese Signalwege bewirken ein Sinken des Blutglucosespiegels durch
- Förderung der Glucose-Aufnahme (GLUT4-Translokation zur Zelloberfläche)
- Förderung der Glucose-Speicherung (Glycogensynthese) in der Leber und den Muskeln
Dieses Signal wird durch die Aktivierung glucoseverbrauchender Wege unterstützt. Weitere unterstützende Maßnahmen bestehen in der Unterdrückung glucoseliefernder Wege, so zum Beispiel durch Abbau des second messenger cAMP über eine Phosphodiesterase.
Glucoseaufnahme im Muskelgewebe
BearbeitenDas Hormon erhöht in der Muskulatur und im Fettgewebe die Permeabilität (Durchlässigkeit) der Zellmembran für Glucose. Dabei ist zu beachten, dass nicht die Membran selbst permeabler wird, sondern dass vermehrt Carrier-Proteine für Glucose aktiviert werden. Dieses Carrier-Protein ist GLUT4, ein hochaffiner, insulinabhängiger Glucose-Transporter, welcher die Glucose durch erleichterte Diffusion (passiver Transport) in die Zelle transportiert. Folgende physikalische Eigenschaften sind für GLUT4 relevant: sättigbar, nicht aktivierbar oder inaktivierbar, also Regulation nur durch insulinabhängigen Einbau oder Ausbau.
Glucoseaufnahme und Stoffwechsel im Gehirn
BearbeitenNervenzellen (und Erythrozyten) nehmen Glucose insulinunabhängig auf. Deshalb nehmen die insulinabhängigen Zellen bei einem erhöhten Insulinspiegel mehr Glucose auf, und für die insulinunabhängigen bleibt weniger übrig.
Im Allgemeinen besteht bei Hypoglykämie die Gefahr, dass das auf Glucose angewiesene Nervensystem geschädigt wird. Insulin wird, verabreicht als Nasenspray in direktem Kontakt mit dem ZNS, zur Behandlung der Alzheimer-Krankheit untersucht.[3]
Auf- und Abbau von Fettgewebe
BearbeitenDas Hormon hemmt die Lipolyse im Fettgewebe und somit den Abbau von Fett. Ein Insulinmangel führt daher zu einer gesteigerten Lipolyse mit Bildung von Ketokörpern und einer daraus resultierenden Ketose.
Förderung des Zellwachstums
BearbeitenEine weitere zentrale Funktion des Peptidhormons Insulin besteht in der Regulation von Zellwachstum und Proliferation durch die Aktivierung der Transkription von Genen, die für Kontrolle und Ablauf des Zellzyklus von großer Bedeutung sind. Diese Insulinwirkung ist bei Diskursen über Insulinpräparate ein Thema. Insulin fördert allgemein das Zellwachstum, auch das von Krebszellen.[4] Eine hohe Insulinkonzentration im Blut (Hyperinsulinäemie) ist als Risikofaktor für Krebswachstum allgemein anerkannt – ganz gleich, ob das Insulin aus der eigenen gesunden Bauchspeicheldrüse stammt (bei einem Menschen ohne Diabetes mellitus) oder mit der Spritze verabreicht wurde (bei einem Menschen mit Diabetes mellitus).[5]
In der DCCT/EDIC-Studie, einer 1983 begonnenen Langzeituntersuchung an Patienten mit Typ-1 Diabetes mellitus, traten 93 Fälle von Krebs bei 1303 Patienten auf. Über die Zeit korrelierte die Krebs-Inzidenz signifikant mit der täglichen Insulindosis pro Kilogramm Körpergewicht: bei <0.5 Einheiten/kg betrug die Inzidenz 2.11 pro 1000 Patientenjahre, bei 0.5 bis 0.8 Einheiten/kg betrug die Inzidenz 2.87 pro 1000 Patientenjahre, und bei > 0.8 Einheiten/kg betrug die Inzidenz 2.91 pro 1000 Patientenjahre. In den USA nutzten 2018 über 90 % der Patienten Insulinanaloga; in dieser Untersuchung wurde nicht differenziert zwischen der Anwendung von Humaninsulin und Insulinanaloga.[6]
Tryptophan-Aufnahme im Gehirn
BearbeitenHöhere Insulinspiegel haben einen leicht steigernden Einfluss auf die Aufnahme von Tryptophan ins Gehirn.[7]
Insulin und die Regelung des Blutzuckerspiegels
BearbeitenEine der wichtigsten biologischen Wirkungen des Insulins ist die rasche Beschleunigung der Glucoseaufnahme in Muskel- und Fettzellen und Regulierung der Zwischenspeicherung in der Leber im Rahmen der Regelung des Blutzuckerspiegels:
- In der Leber und der Muskulatur werden die mit der Nahrung aufgenommenen Kohlenhydrate als Glycogen gespeichert. Dies hat ein Absinken der Glucosekonzentration im Blut zur Folge. Die Glucoseaufnahme in die Leberzellen erfolgt insulinunabhängig über GLUT2. Durch Insulin wird eine Rezeptor-Tyrosinkinase (RTK) aktiviert, die eine Signaltransduktion in Gang setzt. Beteiligt sind dabei das Insulinrezeptorsubstrat 1 (IRS1), die Phosphoinositid-3-Kinase (PI3K), der second messenger Phosphatidylinositol-4,5-bisphosphat (PIP2), die Phosphoinositid-abhängige Kinase-1 (PDK1) und schließlich die Proteinkinase B (PKB) (siehe Bild, A). PKB phosphoryliert die Glycogensynthase-Kinase 3, GSK3, die dadurch inaktiviert wird. GSK3 ist eine Kinase, die die Glycogensynthase phosphoryliert und damit inaktiviert (GYS b). GSK3 steht in Konkurrenz zu einer Phosphatase, der Protein-Phosphatase 1 (PP1). Dadurch, dass GSK3 nicht mehr wirken kann, liegt daher immer mehr Glycogensynthase in seiner dephosphorylierten Form vor (GYS a, siehe unteres Bild, B). Außerdem aktiviert die PKB eine Phosphodiesterase, PDE, die cAMP zu AMP hydrolysiert. Infolgedessen erlischt zusätzlich der Signalweg für die Proteinkinase A, die für den Abbau von Glycogen sorgt.
- In der Leber, dem Fettgewebe und der Muskulatur wird unter Insulineinfluss die Triglyceridsynthese stimuliert. Substrate dafür sind neben den Kohlenhydraten mit der Nahrung aufgenommene Lipide.
- In den drei genannten Geweben werden Aminosäuren verstärkt aufgenommen und für die Proteinsynthese verwendet.
Die metabolischen und mitogenen Effekte von Insulin werden über die Bindung an dessen Rezeptor auf der Zelloberfläche der Zielgewebe Leber, Muskel und Fett initiiert.
- Insulin induziert weiterhin die Glycogensynthese und -speicherung in Leber und Muskel, die Triglyceridsynthese in Leber und Fettgewebe sowie die Speicherung von Aminosäuren im Muskel.
- Gleichzeitig hemmt Insulin die hepatische Gluconeogenese und zählt daher insgesamt zu den wichtigsten Regulatoren des Glucosemetabolismus.
Gegenspieler
BearbeitenFällt der Blutzuckerspiegel im Körper unter einen Wert von 80 mg/dl ab, wird die Insulinproduktion bereits stark reduziert.
Sinkt der Blutzucker weiter ab, treten verschiedene Gegenspieler des Insulins auf:
Die Spiegel dieser gegenregulierenden Hormone steigen bereits deutlich an, wenn der Blutzucker unter 60 mg/dl absinkt.
Beim Typ 1-Diabetes ist oft auch der Gegenregulationmechanismus gestört, was zu zusätzlichen Problemen mit Hypoglykämien führt.
Somatostatin hat einen hemmenden Einfluss auf die Sekretion von Insulin und Glucagon, da er als allgemeiner Hemmer im Körper fungiert.
Wirkung auf den Kaliumspiegel
BearbeitenInsulin senkt den Kaliumspiegel im Blut, indem es dafür sorgt, dass Kalium in das Zellinnere von Hepatozyten und Skelettmuskelzellen verlagert wird, also von extrazellulär nach intrazellulär. Dies erfolgt durch Aktivierung der Natrium-Kalium-ATPase durch Insulin. Insulinpräparate werden daher gemeinsam mit Glucose (zur Vermeidung einer Hypoglykämie) zur Behandlung einer Hyperkaliämie verwendet.[8]
Vorkommen
BearbeitenInsulinsequenzen von mehr als 100 verschiedenen Spezies sind bekannt. Die Proteinsequenzen der jeweiligen Insuline sind sich ähnlich – sie zeigen Sequenzhomologie – sind aber nicht identisch.[9] Über die Unterschiede im chemischen Aufbau von Humaninsulin gegenüber den Insulinen einiger Säugetiere sowie Informationen zu künstlich hergestelltem Insulin siehe Insulinpräparat.
Insulin und Evolution: Genotypen, die in Jäger- und Sammlergesellschaften einen raschen Abbau von Energiereserven bei Nahrungsmangel verhinderten, prädisponieren beim heutigen Lebensstil mit Bewegungsmangel und Nahrungsüberangebot zu Adipositas und Typ-2-Diabetes.[10]
Inwieweit Gene den Glucosestoffwechsel und die damit verbundene Wirkung von Insulin beeinflussen, ist noch nicht zur Gänze geklärt.[11]
Die Homologe des Insulins in Insekten sind die Drosophila Insulin-like Peptides.
Bildung, Speicherung, Freisetzung und Regulierung
BearbeitenBiosynthese
BearbeitenDie Synthese des Hormons erfolgt in den β-Zellen der Langerhansschen Inseln der Bauchspeicheldrüse. Die genetische Information wird von nur einem Genlocus im kurzen Arm des Chromosom 11 codiert. Das Gen besteht aus ungefähr 300 Nukleotiden.[12]
Die mRNA wird zunächst an Ribosomen, die sich auf dem rauen Endoplasmatischen Retikulum (ER) befinden, in das Präproinsulin translatiert, das aus 110 Aminosäuren besteht.
Die weitere Prozessierung erfolgt in zwei Schritten, nach der Faltung des Moleküls durch Bildung von Disulfidbrücken entsteht durch Abspaltung von Signalpeptid und C-Peptid das Insulinmolekül.
|
|
Speicherung
BearbeitenDie Insulinmoleküle werden in den Vesikeln des Golgi-Apparats, der an der Zellmembran der β-Zelle liegt, durch Zink-Ionen zu Hexameren gebunden und so stabilisiert gespeichert (Zink-Insulin-Komplex).
Die hohe Bindungsfreudigkeit von Insulinmolekülen an Zink hat mehrere wichtige Auswirkungen. Insulin ist in der Form von Hexameren und nach dem Zerfall in Dimere noch nicht wirksam, sondern nur als Einzelmolekül. Diese Eigenschaft spielt bei den Insulinpräparaten eine wichtige Rolle. Bei schnellwirkenden Insulinpräparaten ist der zu langsame Zerfall der Molekülverbände unerwünscht und es wird nach Möglichkeiten gesucht den Zerfall zu beschleunigen. Bei langwirkenden Insulinpräparaten wird die Zinkbindung zur Verlängerung der Wirkdauer durch hohe Zinkkonzentrationen gezielt verstärkt. Bei der Entwicklung von oralen Insulinpräparaten wird die Zinkbindung zur Kopplung von Insulin an Transportmoleküle genutzt.
Ausschüttung
BearbeitenDie Ausschüttung von Insulin ins Blut erfolgt durch Exozytose.
Die Insulinausschüttung erfolgt oszillierend. Alle drei bis sechs Minuten wird Insulin in die Blutbahn abgegeben. Nach der Nahrungsaufnahme ist bei Stoffwechselgesunden ein biphasischer Verlauf der Insulinsekretion feststellbar: Der erste „Insulinpeak“ hat seine Spitze nach drei bis fünf Minuten und dauert zehn Minuten. Danach schließt sich eine zweite Phase an, die so lange anhält, wie eine Hyperglykämie besteht.[14] Die erste Phase besteht aus den gespeicherten Insulinmolekülen, die zweite Phase vor allem aus neu gebildetem Insulin.[15]
Das C-Peptid wird erst bei Anstieg des Blutzuckerspiegels aus dem Proinsulin durch Peptidasen herausgeschnitten und gemeinsam mit dem aktiven Insulin und Zink ausgeschüttet. Durch den Nachweis von C-Peptid im Serum kann die endogene Insulinproduktion gemessen werden. So kann bei Diabetikern eine Aussage darüber getroffen werden, wie viel Insulin noch vom Körper selbst hergestellt wird, da das synthetische Produkt keine C-Sequenz enthält.[16]
Nach einem Trauma ist die Insulinsekretion in der Akutphase (etwa 12 bis 24 Stunden) supprimiert.[17]
Regulierung
BearbeitenDie Hauptaufgabe von Insulin besteht darin, im Zusammenwirken mit Glucagon den Blutglucosespiegel ständig zwischen bestimmten Werten zu halten. Gerät der Blutzuckerspiegel unter einen gewissen Wert, droht das hypoglykämische Koma und der Tod, gerät er darüber, drohen Schäden an Gefäßen, Nierenkörperchen und anderen Geweben. Zusammen mit Leptin scheint Insulin aber auch maßgeblichen Anteil an der Energiehomöostase zu haben. Dabei wirkt aber nicht nur Leptin auf Insulin ein, sondern das Insulin wirkt selbst ebenfalls auf das Leptin ein, genauer auf die Aufnahme von Leptin im Gehirn.
Aufgrund der lebenswichtigen Funktion muss die biochemische Implementierung des Regelkreises robust sein. Da Zellen nicht „denken“ können, kann es nur so sein, dass Einzelzellen wie ein Zustandsautomat funktionieren bzw. dass wenige Zellen dermaßen zusammenwirken, dass ein Reiz sinnvoll verrechnet wird.
Der Hauptreiz zur Ausschüttung von Insulin aus der β-Zelle ist der Blutzuckerspiegel (ab 5 mmol Glucose/l Blut), und dieser wird direkt von der β-Zelle „gemessen“. Biochemisch umgesetzt wird das mit Hilfe von ATP-gesteuerten Kaliumkanälen etc., siehe #Glucosegesteuerter Freisetzungsmechanismus.
Die Hormone Gastrin, Sekretin, GIP und GLP-1 modifizieren den grundlegenden Glucose-Insulin-Regelkreis, indem sie auf die β-Zelle wirken. Siehe Inkretin-Effekt.
GIP wird von K-Zellen, welche sich in der Schleimhaut des Duodenums befinden und die Glucose im Chymus „messen“, ins Blut sezerniert und erhöht die Insulinausschüttung der β-Zellen. Das GIP wirkt also auf die β-Zellen zu einem Zeitpunkt ein, wo die Glucose aus der Nahrung noch nicht ins Blut gelangt ist.
GLP-1 wird von L-Zellen, welche sich in der Schleimhaut des Ileum und des Caecum befinden und die Glucose im Chymus „messen“, ins Blut sezerniert und erhöht ebenfalls die Insulinausschüttung der β-Zellen. Der Großteil der Nährstoffe wird bereits im Jejunum extrahiert und ins Blut bzw. in die Lymphe abgegeben. Im Caecum findet keinerlei Absorption von Nährstoffen, sondern hauptsächlich eine Fermentation statt.
Zusätzlich sind β-Zellen sowohl vom parasympathischen als auch sympathische Nervensystem innerviert:
Das parasympathische NS wird bei Leptin-Insuffizienz (oder auch bei Leptin-Resistenz) aktiviert und wirkt allgemein trophotropisch, d. h., es bewirkt die Speicherung von Energie. Es erhöht also die Insulinabgabe. Zumindest bei Mäusen wirkt es außerdem gleichzeitig auf Adipozyten ein und erhöht ihre Empfindlichkeit für Insulin, während die Empfindlichkeit der Leber- und Muskelzellen nicht beeinflusst wird. Glucose wird in Leber- und Muskelzellen zu Glycogen verbaut und derart gespeichert, in den Adipozyten erfolgt De-novo-Lipogenese und Speicherung von TGs.
Das sympathische NS wird bei Leptin-Suffizienz aktiviert und wirkt allgemein ergotropisch, d. h., es bewirkt die Erhöhung des Energieverbrauchs. Es senkt die Insulinabgabe. Die Senkung der Insulinabgabe scheint einem erhöhten Energieverbrauch entgegenzuwirken, denn die Muskelzellen können sehr viel mehr Glucose aus dem Blut aufnehmen, wenn sie möglichst viele GLUT-4 Transporter auf der Oberfläche aufweisen. Sie müssen also auf die bereits gespeicherte Energie in Form von Glycogen und Fettsäuren zurückgreifen.
Glucosegesteuerter Freisetzungsmechanismus
BearbeitenDas Eindringen eines Glucose-Moleküls in die β-Zelle setzt eine Wirkungskette in Gang. Nachdem die Glucose durch den GLUT1-Transporter in die Zelle gelangt ist, wird sie durch Glycolyse verstoffwechselt. Das dabei entstehende ATP hemmt den Ausstrom von Kalium-Ionen (ATP-sensitive Kaliumkanäle). So kommt es durch den stark verminderten Kaliumausstrom zur Depolarisation, weil die Stabilität des Membranpotentials nicht weiter durch Kaliumausstrom erhalten wird. Das depolarisierte Membranpotential bewirkt eine Öffnung spannungsabhängiger Calcium-Kanäle. Der Einstrom der Calciumionen ist der entscheidende Reiz für die Verschmelzung der insulinhaltigen Vesikel mit der Zellmembran.
Die gespeicherten Insulinmoleküle werden durch Verschmelzen der Membranen (Exozytose) aus den β-Zellen in den Extrazellularraum und weiter in den Blutkreislauf freigesetzt. Dabei werden die Speicher-Hexamere aufgetrennt. Der Insulinspiegel im Blut steigt an.
Halbwertszeit und Abbau
BearbeitenDie biologische Halbwertszeit einzelner Insulinmoleküle im Blutkreislauf liegt bei circa fünf Minuten.[14]
Das Insulin wird über manche Insulinrezeptoren in die Zellen aufgenommen, dort abgebaut und somit verbraucht. In der Leber und in der Niere wird Insulin durch Insulinase inaktiviert, die Insulinase oder genauer Glutathion-Insulin-Transhydrogenase spaltet die Disulfidbrücken zwischen der A- und der B-Kette auf, wodurch das Insulin in zwei Teile zerfällt und wirkungslos wird.[19] Die Abbauprodukte werden durch die Niere ausgeschieden, ebenso 1,5 % des noch intakten Insulins.[20] Die kurze Zeitspanne der Aktivität des Insulins zeigt, dass die physiologische Steuerung des Zuckerstoffwechsels im gesunden Körper sehr schnell funktioniert; diese Geschwindigkeit kann bei der Behandlung des Diabetes mellitus praktisch nicht erreicht werden.
Insulin als Arzneistoff
BearbeitenIn der Insulintherapie werden verschiedene Insulinpräparate verwendet. Die häufigste und älteste Verabreichungsart ist die subkutane Injektion. Für diesen Zweck steht eine Reihe von kurz-, mittel- und langwirkenden Humaninsulinen und Insulinanaloga zur Verfügung. Werden diese zur Therapie kombiniert, so ist auf die unterschiedliche Halbwertzeit besonders zu achten.
- sehr schnell und kurz wirkend: Insulin glulisin, Insulin lispro, Insulin aspart
- kurz wirkend: Normalinsulin (= gelöstes Humaninsulin)
- intermediär wirkend: NPH-Insulin, biphasisches Insulin lispro, biphasisches Insulin aspart
- lang wirkend: Insulin detemir, Insulin glargin, Insulin degludec
Peroral ist Insulin unwirksam, da die Eiweißketten im Magen-Darm-Trakt von körpereigenen Enzymen abgebaut werden, bevor sie ihre Wirkung entfalten können. Untersucht wird, inwieweit sich Insuline in Nanopartikel verkapseln lassen, um auf diesem Wege „unverdaut“ in den Blutkreislauf eingeschleust werden zu können.[21] Jüngere Entwicklungen wie Präparate zur Inhalation, die das Insulin über die Atemwege zuführen, haben sich auf dem Markt bisher nicht behaupten können.
In der Vergangenheit wurde Insulin im Rahmen der Insulinschocktherapie zur Behandlung von Menschen mit psychischen Krankheiten eingesetzt. Diese Methode der Behandlung wurde zum Beispiel im biografischen Film A Beautiful Mind an John Nash gezeigt. Dieses Verfahren wird nicht mehr praktiziert.[22]
Missbrauch von Insulin
BearbeitenInsulin steht auf der Liste der verbotenen Doping-Substanzen,[23] da es zu mehreren Zwecken missbraucht werden kann. Da Insulin der durch Somatropin verringerten Glucoseaufnahme in die Muskelzellen entgegenwirkt, wird es oft zur Kompensation dessen unerwünschter Nebenwirkung verwendet (siehe Anabolikum). Andere Anwendungen sind die Förderung der Füllung der Glycogenspeicher bei Ausdauersportlern und die Unterstützung des Aufbaus von Muskelmasse.[24]
Die missbräuchliche Selbstverabreichung von Insulin, um den Blutzuckerspiegel übermäßig abzusenken, führt zum Krankheitsbild der Hypoglycaemia factitia.
Im März 2008 wurde der Krankenpfleger Colin Norris in Newcastle zu einer Freiheitsstrafe von 30 Jahren verurteilt, weil er vier seiner Patientinnen durch Injektion zu hoher Insulindosen ermordet hatte.[25]
Der erste dokumentierte Mord mit Insulin stammt aus dem Jahr 1957.[26]
Zeittafel zur Forschungsgeschichte
Bearbeiten1869 entdeckte Paul Langerhans die Inselzellen im Gewebe der Bauchspeicheldrüse. 1889 könnten Oskar Minkowski und Josef von Mering bei Hunden einen Diabetes mellitus durch die Entfernung der Bauchspeicheldrüse auslösen. Kurz darauf wurden die Inselzellen als endokrines (hormon-produzierendes) Gewebe vermutet. Der französische Physiologe und Endokrinologe Eugene Gley (1857–1930) senkte 1894 den Blutzucker eines Hundes, dem die Bauchspeicheldrüse entfernt wurde, mit einem Pankreasextrakt. Er differenzierte zwischen exokriner und endokriner Funktion und ordnete letztere den Inselzellen zu. Der deutsche Internist Georg Ludwig Zülzer führte am 21. Juni 1906 erstmals eine Injektion mit einem von ihm isolierten und von der Firma Schering hergestellten Kälberpankreasextrakt namens Acomatol am Menschen durch.
1909 tauchte erstmals der Begriff Insulin („von den Inseln“) kommend, auf. Der belgische Pathologe Jean de Meyer (1878–1934) schlug diesen Namen für die noch unbekannte Substanz vor.[27] 1910 benannte der englische Physiologe Edward Albert Sharpey-Schafer die den Diabetikern fehlende Substanz aus dem Pankreas ebenfalls „Insulin“. Wer den Namen zuerst geprägt hat, ist aus den vorliegenden Quellen nicht klar ersichtlich.[28]
1916 gelang es Nicolae Paulescu erstmals, Insulin aus Pankreasgewebe zu gewinnen. Fünf Jahre später isolierten Frederick Banting und Charles Best Insulin aus den Bauchspeicheldrüsen tierischer Feten, sie nannten es „Isletin“. 1922 wurde Insulin erfolgreich bei Patienten angewendet. In diesem Jahr begann auch die industrielle Insulin-Herstellung in Kanada. 1923 erhielten Frederick Banting und John James Rickard Macleod den Nobelpreis für Physiologie oder Medizin für die Entdeckung des Insulins. John Jacob Abel konnte 1926 Insulin in kristallisierter Form herstellen. Zwei Jahre später gelang Oskar Wintersteiner der Nachweis, dass Insulin ein Protein ist. 1958 wurde Frederick Sanger der Nobelpreis für Chemie für seine Arbeiten über die Struktur der Proteine, besonders des Insulins verliehen.
1963 gelang Helmut Zahn und seinem Team die weltweit erste chemische Synthese des Insulins.[29] Im Folgejahr ging der Nobelpreis für Chemie an Dorothy Hodgkin für ihre mit der Röntgenstrukturanalyse durchgeführten Bestimmungen des biochemischen Aufbaus wichtiger Stoffe, wie des Insulins und des Vitamins B12. 1971 wurde die dreidimensionale Proteinstruktur des Insulins von Blundell et al. aufgeklärt.[30] 1982 gelang es erstmals, Humaninsulin durch gentechnisch veränderte Bakterien in großer Menge herzustellen.
Einer der ersten Insulinhersteller in Deutschland war das 1945 in München gegründete Unternehmen Hormon-Chemie,[31] das als Präparate etwa das Depotinsulin Horm, das Thrombokinase-Präparat Tachystypt und den Organextrakt Nucleoton anbot.[32] Das erste schnellwirkende Insulinanalogon Insulin lispro (Handelsname Humalog) kam 1996 auf den Markt, 2000 mit Insulin glargin (Handelsname Lantus) das erste langwirksame Insulinanalogon, 2015 mit Abasaglar (Insulin glargin) das erste Insulin-Biosimilar.
Weblinks
BearbeitenEinzelnachweise
Bearbeiten- ↑ Matthias Otto: Analytische Chemie. John Wiley & Sons, 2011, ISBN 978-3-527-32881-9, S. 557.
- ↑ Jeremy M. Berg, John L. Tymoczko, Lubert Stryer: Biochemie. 6. Auflage. Spektrum-Verlag, 2007, ISBN 978-3-8274-1800-5.
- ↑ S. Craft, L. D. Baker, T. J. Montine et al.: Intranasal insulin therapy for alzheimer disease and amnestic mild cognitive impairment: A pilot clinical trial. In: Archives of Neurology. Band 69, Nr. 1, Januar 2012, S. 29–38, doi:10.1001/archneurol.2011.233.
- ↑ Ernst Chantelau: Insulin-responsiveness of tumor growth. In: Archives Of Physiology and Biochemistry. Band 115, Nr. 2, 2009, S. 47–48, doi:10.1080/13813450802709029 (englisch).
- ↑ L. Sciacca, V. Vella, L. Frittitta, A.Tumminia, L. Manzella, S.Squatrito, R. Vigneri, A.Belfiore: Long-acting insulin analogs and cancer. In: Nutrition, Metabolism and Cardiovascular Diseases. Band 28, Nr. 5, 2018, S. 436–443, doi:10.1016/j.numecd.2018.02.010 (englisch).
- ↑ Wenjun Zhong, Yuanjie Mao.: Daily insulin dose and cancer risk among patients with type 1 diabetes. In: JAMA Oncology. Band 8, Nr. 9, 2022, S. 1356–1358, doi:10.1001/jamaoncol.2022.2960 (englisch).
- ↑ P. M. Daniel, E. R. Love, S. R. Moorhouse, O. E. Pratt: The effect of insulin upon the influx of tryptophan into the brain of the rabbit. In: J Physiol. Vol 312, März 1981, S. 551–562, doi:10.1113/jphysiol.1981.sp013643
- ↑ „Oje, das Kalium ist 7,2 mmol/l“. (PDF) Abgerufen am 6. Oktober 2018 (Vorlesung der Medizinischen Universität Wien).
- ↑ So haben auch der Mensch, der Schimpanse, die Maus, das Kaninchen und der Zebrafisch ähnliche, aber nicht identische Insuline: Species Sequence Alignment of Insulin.
- ↑ J. Vander Molen, L. M. Frisse, S. M. Fullerton, Y. Qian, L. Del Bosque-Plata, R. R. Hudson, A. Di Rienzo: Population genetics of CAPN10 and GPR35: implications for the evolution of type 2 diabetes variants. In: American Journal of Human Genetics. Band 76, Nummer 4, April 2005, S. 548–560, doi:10.1086/428784. PMID 15696418, PMC 1199293 (freier Volltext).
- ↑ Gene beeinflussen Glucosestoffwechsel. In: aerzteblatt.de. 18. Januar 2010, archiviert vom (nicht mehr online verfügbar) am 26. November 2015; abgerufen am 25. November 2015.
- ↑ David Owerbach, Graeme I. Bell, William J. Rutter, Thomas B. Shows: The insulin gene is located on chromosome 11 in humans. In: Nature. 286, 1980, S. 82, doi:10.1038/286082a0.
- ↑ a b UniProt P01308
- ↑ a b Helmut Schatz (Hrsg.): Diabetologie kompakt. 4. Auflage. 2006, ISBN 3-13-137724-0.
- ↑ Heiner Laube: Insulinresistenz. Pathophysiologie, Therapie und Perspektiven. Uni-Med, 2001, ISBN 3-89599-541-X.
- ↑ Florian Horn: Biochemie des Menschen: das Lehrbuch für das Medizinstudium. 5. Auflage. Thieme, Stuttgart 2012, ISBN 978-3-13-130885-6, S. 351.
- ↑ Karl.-Heinz Altemeyer, Wulf Seeling, J. E. Schmitz, Bernd Koßmann: Posttraumatischer Stoffwechsel – Grundlagen und klinische Aspekte. In: Der Anaesthesist. Band 33, Heft 1, Januar 1984, S. 4–10, hier: S. 4 und 7–8.
- ↑ Mark E Daly: Acute effects on insulin sensitivity and diurnal metabolic profiles of a high-sucrose compared with a high starch diet. In: Am J Clin Nutr. Nr. 67, 1998, S. 1186–1196 (englisch, ajcn.org [PDF; abgerufen am 19. Februar 2011]).
- ↑ Skriptum Biochemie 2. Fachschaft Medizin der Uni München; archive.org
- ↑ Hagers Handbuch der pharmazeutischen Praxis. S. 552.
- ↑ Yu-Hsin Lin u. a.: Preparation and Characterization of Nanoparticles Shelled with Chitosan for Oral Insulin Delivery. In: Biomacromolecules. 8 (1), 2007, S. 146–152. doi:10.1021/bm0607776
- ↑ Hans Bangen: Geschichte der medikamentösen Therapie der Schizophrenie. Berlin 1992, S. 43–56, ISBN 3-927408-82-4
- ↑ WADA: The Prohibited List 2007 ( vom 21. April 2014 im Internet Archive) (PDF; 125 kB)
- ↑ Dopingnews: Insulin ( vom 7. Juni 2007 im Internet Archive)
- ↑ Tom Chivers: Colin Norris, ‘Angel of Death’ nurse, convicted. In: The Telegraph. 2. März 2008, abgerufen am 6. September 2016 (englisch).
- ↑ Vincent Marks, Caroline Richmond: Kenneth Barlow: The first documented case of murder by insulin. In: Journal of the Royal Society of Medicine. Band 101, Nr. 1, Januar 2008, S. 19–21, doi:10.1258/jrsm.2007.071002, PMID 18263909, PMC 2235920 (freier Volltext).
- ↑ Jacek Zajac, Anil Shrestha, Parini Patel, Leonid Poretsky: Principles of Diabetes Mellitus. Hrsg.: Leonid Poretsky. Springer US, New York 2010, ISBN 978-0-387-09840-1, Kapitel The Main Events in the History of Diabetes Mellitus, S. 3–16, doi:10.1007/978-0-387-09841-8_1 (friedmanfellows.com [PDF]).
- ↑ Vivienne Baillie Gerritsen: Protein of the 20th century. In: Protein Spotlight. 9. April 2001.
- ↑ Helmut Zahn, Johannes Meienhofen, Dietrich Brandenburg u. a.: Synthese der Insulinketten und ihre Kombination zu insulinaktiven Präparaten. In: Zeitschrift für Naturforschung B. 18, 1963, S. 1120–1121 (online).
- ↑ T. L. Blundell, J. F. Cutfield, S. M. Cutfield et sl.: Atomic positions in rhombohedral 2-zinc insulin crystals. In: Nature. Band 231, Nr. 5304, Juni 1971, S. 506–511, PMID 4932997.
- ↑ www.innomonitor.de.
- ↑ Horm. In: Münchener Medizinische Wochenschrift. Band 95, Nr. 1, 2. Januar 1953, S. LXXXII.