Kaliumdisulfat
Kaliumdisulfat oder Kaliumpyrosulfat K2S2O7 ist das Kaliumsalz der Dischwefelsäure.
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
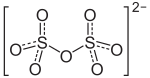 | |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Kaliumdisulfat | ||||||||||||||||||
| Andere Namen |
| ||||||||||||||||||
| Summenformel | K2S2O7 | ||||||||||||||||||
| Kurzbeschreibung |
weißer, geruchloser Feststoff[1] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 254,32 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
fest | ||||||||||||||||||
| Dichte |
2,28 g·cm−3[1] | ||||||||||||||||||
| Schmelzpunkt |
419 °C[2] | ||||||||||||||||||
| Löslichkeit |
löslich in Wasser[1]; reagiert unter Zersetzung | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | |||||||||||||||||||
Eigenschaften und Darstellung
BearbeitenDikaliumdisulfat ist ein hygroskopischer, feuchtigkeitsempfindlicher, weißer und geruchloser Feststoff, welcher löslich in Wasser ist, wobei seine wässrige Lösung stark sauer reagiert.[1]
Es entsteht beim Erhitzen von Kaliumhydrogensulfat:[3]
- .
Bei weiterem Erhitzen zerfällt das Kaliumdisulfat bei ca. 600 °C in Kaliumsulfat und Schwefeltrioxid:
- .
Kaliumdisulfat reagiert als eine Lewissäure mit Wasser zu stark saurem Kaliumhydrogensulfat:[4]
- .
Verwendung
BearbeitenKaliumdisulfat kann bei der Veresterung von Alkanolen mit Carbonsäuren anstelle einer Säure als ein Katalysator verwendet werden. Da das Kaliumdisulfat dabei mit dem Reaktionswasser zu stark saurem Kaliumhydrogensulfat reagiert, kann sich bei diesem Verfahren kein Chemisches Gleichgewicht einstellen. Bei einem Überschuss an Kaliumdisulfat verläuft diese Reaktion deshalb quantitativ:[5]
Kaliumdisulfat kann für einen heißen, sauren Aufschluss von Salzen verwendet werden:
Das dabei gebildete Eisen(III)-sulfat ist wasserlöslich.
Toxikologie
BearbeitenFür die aktuelle GHS-Einstufung von Kaliumdisulfat sind keine eigenen toxikologischen Studien dokumentiert, sondern es wurden hierfür Studien, die mit Schwefelsäure durchgeführt wurden, verwendet. Die hieraus resultierende GHS-Einstufung als schwer ätzendes Gift ist strenger als die von konzentrierter Schwefelsäure[6]. Mit Wasser zersetzt sich Kaliumdisulfat spontan und quantitativ zu Kaliumhydrogensulfat. Demzufolge ist Kaliumdisulfat weniger gefährlich als Schwefelsäure und kann, wenn möglich, als ein Ersatzstoff für konzentrierte Schwefelsäure dienen[7].
Einzelnachweise
Bearbeiten- ↑ a b c d e f Eintrag zu Dikaliumdisulfat in der GESTIS-Stoffdatenbank des IFA, abgerufen am 8. Januar 2021. (JavaScript erforderlich)
- ↑ S. B. Rasmussen, K. M. Eriksen, G. Hatem, F. da Silva, K. Ståhl, R. Fehrmann: Conductivity, Thermal Measurements, X-ray Investigations, and Phase Diagram of the Na2S2O7-K2S2O7 System. In: The Journal of Physical Chemistry B. 105, 2001, S. 2747–2752, doi:10.1021/jp0039262.
- ↑ ASTM International: A Manual for the Chemical Analysis of Metals. ASTM International, S. 86 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ E. Thilo, F. von Lampe: Beiträge zur Chemie der Alkalidi(=pyro)sulfate. In: Zeitschrift für anorganische und allgemeine Chemie. Band 319, Nr. 5-6, Januar 1963, S. 387–403, doi:10.1002/zaac.19633190519.
- ↑ R. Criegee, H. Henecka, P. Kurtz, S. Petersen, H.-F. Piepenbrink: Methoden der Organischen Chemie (Houben-Weyl), VIII: Sauerstoffverbindungen 3, A. Herstellung von Carbonsäureestern. 4. Auflage. Thieme Verlag, 1952, ISBN 978-3-13-207204-6, doi:10.1055/b-003-111688.
- ↑ Registrierungsdossier zu Dipotassium disulphate (Abschnitt 7/3/1) bei der Europäischen Chemikalienagentur (ECHA), abgerufen am 23. Juli 2023.
- ↑ Klemeyer, Horst (2023) Sicheres Experimentieren – Experimente mit ätzenden Stoffen und Gemischen, doi:10.1002/ckon.202300001.

