Kaliumtetrachloroaurat(III)
Kaliumtetrachloroaurat, nach IUPAC Kaliumtetrachloridoaurat, K[AuCl4] ist eine anorganische Verbindung der Tetrachlorogoldsäure mit dem Alkalimetall Kalium.
| Kristallstruktur | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| |||||||||||||||||||
| _ K+ _ Au3+ _ Cl− | |||||||||||||||||||
| Kristallsystem | |||||||||||||||||||
| Raumgruppe |
Pc (Nr. 7) | ||||||||||||||||||
| Gitterparameter |
| ||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Kaliumtetrachloroaurat(III) | ||||||||||||||||||
| Andere Namen |
Goldchloridkalium | ||||||||||||||||||
| Verhältnisformel | K[AuCl4] | ||||||||||||||||||
| Kurzbeschreibung |
gelb-oranges Pulver[1] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 377,86 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
fest | ||||||||||||||||||
| Schmelzpunkt |
300 °C[2] | ||||||||||||||||||
| Löslichkeit |
löslich in Wasser[2] | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | |||||||||||||||||||
Eigenschaften
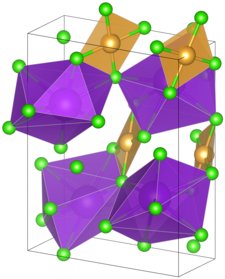
BearbeitenKaliumtetrachloroaurat ist ein geruchsloses, gelb-oranges Pulver. Die Verbindung ist unter Normalbedingungen stabil und lichtempfindlich.[1] Der Schmelzpunkt liegt bei ca. 300 °C.[2] Das Kaliumsalz besitzt ein monoklines Kristallsystem mit der Raumgruppe Pc (Raumgruppen-Nr. 7). Die Gitterparameter liegen bei a = 8,671 Å, b = 6,386 Å und c = 12,243 Å, sowie β = 95,37°.[3]
Verwendung
BearbeitenIn Tonbad ist unter anderem Kaliumtetrachloroaurat(III) enthalten. Die Lösung wird zur Behandlung von Albuminpapier verwendet.
Sicherheitshinweise
BearbeitenDas Salz verursacht bei Kontakt mit der Haut, den Augen oder den Atemwegen Reizungen. Die Chemikalie sollte nicht verschluckt werden, da Schäden auftreten können.[2]
Kaliumtetrachloroaurat reagiert heftig mit Ammoniak NH3, starken Oxidationsmitteln und pulverförmigen Metallen. Bei der Verbrennung des Stoffes kann unter anderem Chlorwasserstoff entstehen.[1]
Einzelnachweise
Bearbeiten- ↑ a b c Eintrag zu Potassium tetrachloroaurate(III) bei Thermo Fisher Scientific, abgerufen am 13. Oktober 2023.
- ↑ a b c d e f Datenblatt Kaliumtetrachloroaurat(III) (PDF) bei Carl Roth, abgerufen am 2. Februar 2019.
- ↑ M. Bonamico, G. Dessy: The crystal structure of anhydrous potassium tetrachloroaurate(III). In: Acta Cryst. 1973, S. 1735–1736, doi:10.1107/S0567740873005406.
