Lithiumchromat
Lithiumchromat ist das Lithiumsalz der Chromsäure. Es ist ein starkes Oxidationsmittel und wie alle Chromate toxisch und krebserregend.
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
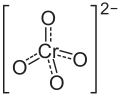
| |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Lithiumchromat | ||||||||||||||||||
| Summenformel | Li2CrO4 | ||||||||||||||||||
| Kurzbeschreibung |
gelbe geruchlose Kristalle[1] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 129,87 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
fest | ||||||||||||||||||
| Dichte |
2,15 g·cm−3 (Dihydrat)[1] | ||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Löslichkeit |
gut in Wasser (48,6 g·l−1 bei 20 °C)[1] | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | |||||||||||||||||||
Darstellung
BearbeitenLithiumchromat kann aus Lithiumcarbonat und Chromsäure hergestellt werden.[4][5]
Eigenschaften
BearbeitenDas Dihydrat kristallisiert im orthorhombischen Kristallsystem in der Raumgruppe P212121 (Raumgruppen-Nr. 19) mit den Gitterkonstanten a = 774,6 pm, b = 1201 pm und c = 550,9 pm sowie vier Formeleinheiten pro Elementarzelle.[6][7]
Das Anhydrat kristallisiert in der Phenakit-Struktur trigonal in der Raumgruppe R3 (Raumgruppen-Nr. 148) mit den Gitterparametern a = 14,01 Å und c = 9,41 Å sowie 18 Formeleinheiten pro Elementarzelle.[8]
Versetzt man Lithiumchromat mit Salpetersäure, so entsteht Lithiumdichromat.[5]
Beim Glühen mit Lithiumoxid bildet sich Lithiumchromat(V) Li3CrO4.[9][10]
Verwendung
BearbeitenEine wässrige Lösung von Lithiumchromat wird als Korrosionsinhibitor sowie als Additiv in Batterien verwendet. Das Dihydrat wird daneben auch als Oxidationsmittel eingesetzt.[1]
Einzelnachweise
Bearbeiten- ↑ a b c d e f Dale L. Perry, Sidney L. Phillips: Handbook of inorganic compounds. CRC Press, 1995, ISBN 978-0-8493-8671-8, S. 223 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ Eintrag zu Lithiumchromat in der GESTIS-Stoffdatenbank des IFA, abgerufen am 23. Juli 2016. (JavaScript erforderlich)
- ↑ Nicht explizit in Verordnung (EG) Nr. 1272/2008 (CLP) gelistet, fällt aber mit der angegebenen Kennzeichnung unter den Gruppeneintrag Chromium (VI) compounds, with the exception of barium chromate and of compounds specified elsewhere in this Annex im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 1. Februar 2016. Hersteller bzw. Inverkehrbringer können die harmonisierte Einstufung und Kennzeichnung erweitern.
- ↑ R. Abegg, F. Auerbach, I. Koppel: Handbuch der anorganischen Chemie. Verlag S. Hirzel, 1908, 2. Band, 1. Teil, S. 140. Volltext
- ↑ a b C. Rammelsberg: "Ueber die Isomorphie der Lithionsalze mit den Kali- und Natronsalzen" in Pogg. Ann 1866, 128, S. 311 ff. Volltext
- ↑ Jean D’Ans, Ellen Lax: Taschenbuch für Chemiker und Physiker. 3. Elemente, anorganische Verbindungen und Materialien, Minerale, Band 3. 4. Auflage, Springer, 1997, ISBN 978-3-540-60035-0, S. 398 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ H. Barlage, H. Jacobs: "Li2CrO4 · 2H2O: Ungewöhnliche Wasserstoffbrückenbindung und Koordination der O-Liganden des Anions CrO42−" in Zeitschr. f. anorg. und allg. Chem. 1996, 622(4), S. 721–723. doi:10.1002/zaac.19966220426
- ↑ I. D. Brown, R. Faggiani: "Refinement of the crystal structure of lithium chromate" in Acta Cryst. 1975, B31, S. 2364–2365. doi:10.1107/S0567740875007625
- ↑ K. A. Wilhelmi, O. Jonsson: X-Ray Studies on Some Alkali and Alkaline-Earth Chromates(V). In: Acta Chem. Scand. 1965, 19, doi:10.3891/acta.chem.scand.19-0177, S. 177–184.
- ↑ R. Scholder, H. Schwarz: "Über Alkalichromate(V)" in Zeitschrift für anorganische und allgemeine Chemie 1963, 326(1-2) S. 1–10. doi:10.1002/zaac.19633260102


