Loncastuximab-Tesirin
Loncastuximab-Tesirin (auch Loncastuximab tesirin geschrieben) ist ein Antikörper-Wirkstoff-Konjugat, das als Arzneistoff zur Behandlung bestimmter Krebsarten des Lymphsystems (B-Zell-Lymphomen) eingesetzt wird.
| Strukturformel | ||||||||||
|---|---|---|---|---|---|---|---|---|---|---|
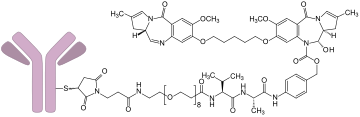
| ||||||||||
| Allgemeines | ||||||||||
| Name | Loncastuximab-Tesirin | |||||||||
| Andere Namen |
| |||||||||
| Summenformel |
| |||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||
| ||||||||||
| Arzneistoffangaben | ||||||||||
| ATC-Code | ||||||||||
| Eigenschaften | ||||||||||
| Molare Masse | 151 kDa | |||||||||
| Sicherheitshinweise | ||||||||||
| ||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | ||||||||||
Es wurde im April 2021 in den USA unter dem Namen Zynlonta (ADC Therapeutics) zugelassen.
Eigenschaften
BearbeitenLoncastuximab-Tesirin ist ein Antikörper-Wirkstoff-Konjugat (antibody drug conjugate, ADC) und besteht aus folgenden Komponenten:[2]
- dem chimären monoklonalen Antikörper Loncastuximab,[3] der zielgerichtet an das B-Lymphozytenantigen CD19 bindet, einem Transmembranprotein, das auf der Oberfläche von Zellen aus der B-Linie exprimiert wird;
- der niedermolekularen Komponente Tesirin.[4] Tesirin wiederum enthält zur Anknüpfung an den Antikörper eine Maleimid-Struktur, die über einen Valin-Alanin-Linker mit einem alkylierend wirksamen Pyrrolo[2,1-c][1,4]benzodiazepin-Dimer (PBD-Dimer), dem SG-3199, verbunden ist. Nach Internalisierung des ADC wird SG-3199 durch proteolytische Spaltung des Linkers aus dem Konjugat freigesetzt und entfaltet seine zytotoxische Wirkung an den Krebszellen.
Loncastuximab wird in gentechnisch veränderter Ovarialzellen des Chinesischen Zwerghamsters (CHO-Zellen) produziert, während die niedermolekularen Komponenten durch chemische Synthese hergestellt werden. Durchschnittlich kommen auf jedes Antikörpermolekül 2,3 Moleküle Tesirin. Tesirin wurde entwickelt, um die Antitumor-Aktivität von PDBs mit gewünschten physikochemischen Eigenschaften wie günstiger Hydrophobie und guten Konjugationseigenschaften zu kombinieren.[5]
Wirkungsmechanismus
BearbeitenPyrrolobenzodiazepine (PBD) sind DNA-interaktive Tumortherapeutika, die sequenzselektiv an die Guaninbasen der kleinen Furche der DNA binden. Sie sind stark zytotoxisch und werden als Wirkstoffkomponente in Antikörper-Wirkstoff-Konjugaten (ADCs) entwickelt und verwendet.[6]
Therapeutische Verwendung
BearbeitenDie Zulassung umfasst die Behandlung von erwachsenen Patienten mit rezidiviertem oder refraktärem diffusen großzelligen B-Zell-Lymphom (DLBCL) in der Dritt- oder Mehrlinientherapie (einschließlich Patienten mit nicht anderweitig spezifiziertem DLBCL, ferner DLBCL, das aus einem niedriggradigen Lymphom entsteht, sowie hochgradigem B-Zell-Lymphom).
Loncastuximab-Tesirin wurde unter dem Namen Zynlonta im April 2021 in den USA[7] und im Dezember 2022 in der EU[8] zugelassen.
Studien
BearbeitenDie Zulassung durch die Food and Drug Administration (FDA) erfolgte nach einem beschleunigten Verfahren mit Auflagen (accelerated approval). Sie basiert auf der offenen, einarmigen Studie LOTIS-2[9] mit 145 erwachsenen Patienten mit rezidiviertem oder refraktärem DLBCL oder hochgradigem B-Zell-Lymphom nach mindestens zwei vorangegangenen systemischen Therapien. Die Patienten erhielten Loncastuximab-Tesirin in mehreren Zyklen gemäß dem Studienprotokoll, bis zum Fortschreiten der Erkrankung oder dem Auftreten einer nicht mehr akzeptablen Toxizität. Maßgeblich für die Beurteilung der Wirksamkeit war die Gesamtansprechrate (overall response rate, ORR), die von einem unabhängigen Prüfungsausschuss anhand der Lugano-Kriterien 2014 bewertet wurde. Die ORR betrug 48,3 % und die vollständige Ansprechrate 24,1 %. Nach einer medianen Nachbeobachtungszeit von 7,3 Monaten betrug die mediane Ansprechdauer 10,3 Monate.[7]
Nebenwirkungen und Anwendungsbeschränkungen
BearbeitenDie häufigsten Nebenwirkungen, die bei mehr als 20 Prozent der behandelten Patienten beobachtet wurden, waren Thrombozytopenie, erhöhte Gamma-Glutamyltransferase, Neutropenie, Anämie, Hyperglykämie, Transaminasenanstieg, Müdigkeit, Hypoalbuminämie, Hautausschlag, Ödeme, Übelkeit und Muskel-Skelett-Schmerzen.[2]
Handelsnamen
BearbeitenZynlonta (USA, EU)
Einzelnachweise
Bearbeiten- ↑ Dieser Stoff wurde in Bezug auf seine Gefährlichkeit entweder noch nicht eingestuft oder eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- ↑ a b Zynlonta - Prescribing Information, ADC Therapeutics, April 2021 (PFD)
- ↑ Externe Identifikatoren von bzw. Datenbank-Links zu Loncastuximab: CAS-Nr.: 1875032-68-0, Wikidata: Q107413698.
- ↑ Externe Identifikatoren von bzw. Datenbank-Links zu Tesirin: CAS-Nr.: 1595275-62-9, PubChem: 73672523, Wikidata: Q107413711. Anderer Name: SG-3249
- ↑ Arnaud C. Tiberghien et al.: Design and Synthesis of Tesirine, a Clinical Antibody–Drug Conjugate Pyrrolobenzodiazepine Dimer Payload. In: ACS Medicinal Chemistry Letters. 24. Mai 2016, doi:10.1021/acsmedchemlett.6b00062.
- ↑ J. Mantaj, P. J. M. Jackson, K. M. Rahman, D. E. Thurston: Entwicklung Pyrrolobenzodiazepin(PBD)-haltiger Antikörper-Wirkstoff-Konjugate (ADCs) ausgehend von Anthramycin. In: Angewandte Chemie. Band 129, Nr. 2, 15. November 2016, S. 474–502, doi:10.1002/ange.201510610.
- ↑ a b FDA grants accelerated approval to loncastuximab tesirine-lpyl for large B-cell lymphoma Food and Drug Administration (FDA), 23. April 2021.
- ↑ Eintrag EU/1/22/1695 im EU-Register für Humanarzneimittel, Europäische Kommission. Abgerufen am 11. Januar 2023.
- ↑ Klinische Studie (Phase II): Study to Evaluate the Efficacy and Safety of Loncastuximab Tesirine in Patients With Relapsed or Refractory Diffuse Large B-Cell Lymphoma (LOTIS-2) bei Clinicaltrials.gov der NIH