Mifamurtid
Mifamurtid (Handelsname Mepact®; Hersteller Takeda Pharmaceutical Company) ist ein Arzneistoff, der zur Behandlung von Osteosarkomen, einer seltenen bösartigen Knochentumorerkrankung, bei Kindern, Jugendlichen und jungen Erwachsenen eingesetzt werden soll.[2][3] Mifamurtid wurde als ein Orphan-Arzneimittel eingestuft und 2009 von der Europäischen Kommission zur Therapie zugelassen.[4]
| Strukturformel | |||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
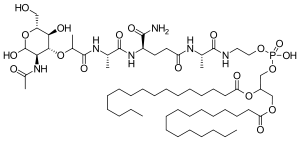
| |||||||||||||
| Allgemeines | |||||||||||||
| Freiname | Mifamurtid | ||||||||||||
| Summenformel | C59H109N6O19P (Mifamurtid) | ||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||
| |||||||||||||
| Arzneistoffangaben | |||||||||||||
| ATC-Code | |||||||||||||
| Wirkstoffklasse | |||||||||||||
| Eigenschaften | |||||||||||||
| Molare Masse | 1237,50 g·mol−1 | ||||||||||||
| Sicherheitshinweise | |||||||||||||
| |||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | |||||||||||||
Geschichte
BearbeitenMifamurtid wurde in den frühen 1980er Jahren von Ciba-Geigy für die Anwendung in der Tumortherapie entwickelt. Nach ersten klinischen Studien wurden in den 1990er Jahren die Rechte an Jenner Biotherapies verkauft. Nachdem Mifamurtid 2001 den Status eines Orphan-Arzneimittels von der US-amerikanischen Food and Drug Administration (FDA) zugesprochen bekommen hatte, erwarb IDM Pharma die Rechte an Mifamurtid und entwickelte es weiter. 2004 erkannte auch die Europäische Arzneimittelagentur Mifamurtid den Orphan-Arzneimittel-Status zu.[5] Nach einem gescheiterten Zulassungsantrag in den USA 2007 erteilte 2009 die Europäische Kommission dem Unternehmen IDM Pharma SAS eine Genehmigung für das Inverkehrbringen von Mifamurtid (Handelsname: Mepact) in der Europäischen Union. Im gleichen Jahr wurde IDM Pharma und Mepact von dem pharmazeutischen Unternehmen Takeda übernommen.
Klinische Angaben
BearbeitenAnwendungsgebiete (Indikationen)
BearbeitenMifamurtid ist zur Behandlung von Osteosarkomen bei Kindern, Jugendlichen und jungen Erwachsenen zugelassen. Für Patienten mit einem Alter von über 30 Jahren liegen keine ausreichenden Erfahrungen vor.[4]
Klinische Studien
BearbeitenMifamurtid wurde u. a. im Rahmen einer Phase-III-Studie untersucht, an der 678 Patienten im Alter von ein bis 31 Jahren mit hochmalignem, nicht metastasiertem Osteosarkom teilnahmen. Nach der chirurgischen Entfernung des Tumors erhielten alle Patienten eine adjuvante Chemotherapie in verschiedenen Kombinationen. Die Hälfte der Patienten wurden zusätzlich mit dem Immunmodulator Mifamurtid behandelt: Unter der Therapie mit Mifamurtid überlebten 68 % der Patienten (231 von 338), ohne dass die Krankheit wiederkehrte. Die entsprechende Zahl bei den Patienten, die kein Mifamurtid erhielten, lag bei 61 % (207 von 340). Im Vergleich zur Therapie ohne Mifamurtid verringerte die Behandlung mit Mifamurtid das Sterberisiko um 28 %.[4]
Gegenanzeigen (Kontraindikationen)
BearbeitenAußer einer bekannten Überempfindlichkeit gegen den Wirkstoff gelten eine gleichzeitige Behandlung mit Ciclosporin und anderen Calcineurin-Inhibitoren sowie eine Behandlung mit hochdosierten nichtsteroidalen Antirheumatika als Kontraindikation.[4]
Wechselwirkungen
BearbeitenHochdosierte nichtsteroidale Antirheumatika hemmen die Wirkung von Mifamurtid auf die Makrophagen. Auch eine längerfristige Anwendung von immunsupprimierenden Glucocorticoiden hemmt die anregende Wirkung von Mifamurtid auf das Immunsystem. Ciclosporin und andere Calcineurin-Inhibitoren können zumindest theoretisch die Funktion der Milzmakrophagen und mononukleären Phagozyten beeinflussen. Lipophile Arzneistoffe, wie beispielsweise Doxorubicin, sollen zeitlich getrennt verabreicht werden. Dem gegenüber zeigt Mifamurtid keine Wechselwirkungen mit dem Cytochrom-P450-Enzymsystem. Ebenso konnten keine Interaktionen mit Cisplatin, Ifosfamid und hochdosiertem Methotrexat nachgewiesen werden.[4]
Unerwünschte Arzneimittelwirkungen
BearbeitenMifamurtid zeigt charakteristische Nebenwirkungen von Arzneistoffen in der aktiven Immuntherapie. Nahezu alle Patienten (ca. 90 %) litten unter Fieber und Schüttelfrost. Zu den häufigsten Nebenwirkungen, die etwa 50 % der Patienten betreffen, zählen Übelkeit, Erbrechen, Müdigkeit, Tachykardie und Kopfschmerzen. Sehr häufig (>10 %) treten auch Dyspnoe, Husten, Schwitzen, Hypertonie, Hypotonie, Schwindel, Durchfall, Verstopfungen, Appetitlosigkeit, Bauchschmerzen, Rücken-, Gelenk- und Muskelschmerzen auf.[4]
Pharmakologie
BearbeitenPharmakodynamik
BearbeitenDie tumorhemmende Wirkung von Mifamurtid beruht auf einer Aktivierung von Monozyten und Makrophagen.[4] Als ein vollsynthetisches Analogon des Muramyldipeptids, dem kleinsten natürlich vorkommenden immunstimulierenden Bestandteil der Zellwand von Mycobakterien, hat Mifamurtid vergleichbare immunstimulierende Eigenschaften und simuliert eine bakterielle Infektion. Seine immunstimulierende Wirkung basiert auf der Interaktion mit NOD2, einem Rezeptor, der hauptsächlich auf Monozyten, dendritischen Zellen und Makrophagen vorkommt. Diese Interaktion führt zu einer vermehrten Bildung und Freisetzung von Zytokinen und Adhäsionsmolekülen, wie TNF-α, Interleukin-1, Interleukin-6, Interleukin-8, Interleukin-12, Lymphozytenfunktionsassoziiertes Antigen-1 und ICAM-1 und zu einer Aktivierung weißer Blutzellen. Diese sind in der Lage, zumindest in vitro Tumorzellen anzugreifen. Der genaue tumorhemmende Mechanismus in vivo ist noch nicht bekannt.[4]
Pharmakokinetik
BearbeitenNach Infusion des in liposomaler Form verabreichten Mifamurtids wird der Arzneistoff rasch innerhalb weniger Minuten aus dem Plasma entfernt und in der Leber, der Milz, dem Nasenrachen und der Schilddrüse angereichert. Seine terminale Halbwertzeit beträgt etwa 18 Stunden. Kumulationseffekte nach einer zweiten Behandlung nach 11 bis 12 Wochen konnten nicht beobachtet werden.[4]
Chemie
BearbeitenChemische Eigenschaften
BearbeitenMifamurtid ist ein sehr lipophiler Arzneistoff, der kaum wasserlöslich ist. Als ein Phospholipid reichert sich in der Lipiddoppelschicht der Liposomen, die als Vehikel verwendet werden, an.[6]
Synthese
BearbeitenFür die Herstellung von Mifamurtid wurden zwei Methoden beschrieben. Die erste beruht auf der Veresterung von N-Acetylmuramyl-L-alanyl-D-isoglutaminyl-L-alanin mit N-Hydroxysuccinimid und einer anschließenden Kondensationsreaktion mit 2-Aminoethyl-2,3-dipalmitoylglycerylphosphorsäure.[7] Die zweite Synthesevariante geht von N-Acetylmuramyl-L-alanyl-D-isoglutamin und einer Umsetzung mit L-Alanyl-2-aminoethyl-2,3-dipalmitoylglycerylphosphorsäure nach Aktivierung mit Hydroxysuccinylimin aus.[8]
Weblinks
Bearbeiten- Öffentlicher Beurteilungsbericht (EPAR) der Europäischen Arzneimittel-Agentur (EMA) zu: Mifamurtid
Einzelnachweise
Bearbeiten- ↑ Dieser Stoff wurde in Bezug auf seine Gefährlichkeit entweder noch nicht eingestuft oder eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- ↑ Frampton JE. Mifamurtide: a review of its use in the treatment of osteosarcoma. In: Paediatr Drugs 2010; 12: 141–153, PMID 20481644.
- ↑ Ando K et al. Mifamurtide for the treatment of nonmetastatic osteosarcoma. In: Expert Opin Pharmacother. 2011; 12: 285–292, PMID 21226638.
- ↑ a b c d e f g h i Zusammenfassung des Europäischen Öffentlichen Beurteilungsberichts (EPAR) für Mepact (Mifamurtid). online (pdf; 132 kB).
- ↑ Mifamurtide: CGP 19835, CGP 19835A, L-MTP-PE, liposomal MTP-PE, MLV 19835A, MTP-PE, muramyltripeptide phosphatidylethanolamine. In: Drugs R D. 9. Jahrgang, Nr. 2, 2008, S. 131–5, PMID 18298131.
- ↑ Fidler IJ et al.: Efficacy of liposomes containing a lipophilic muramyl dipeptide derivative for activating the tumoricidal properties of alveolar macrophages in vivo. In: J. Biol. Response Modif. 1. Jahrgang, 1982, S. 43–55.
- ↑ Prous JR, Castaner J: ENV 2-3/MTP-PE. In: Drugs Fut. 14. Jahrgang, Nr. 3, 1989, S. 220.
- ↑ Brundish DE, Wade R: Synthesis of N-[2-3H]acetyl-D-muramyl-L-alanyl-D-iso-glutaminyl-L-alanyl-2-(1',2'-dipalmitoyl-sn-glycero-3'-phosphoryl)ethylamide of high specific radioactivity. In: J Label Compd Radiopharm. 22. Jahrgang, Nr. 1, 1985, S. 29–35.