Natriumdisulfat
Natriumdisulfat, auch als Natriumpyrosulfat bezeichnet, ist das Dinatriumsalz der Dischwefelsäure.
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
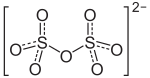
| |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Natriumdisulfat | ||||||||||||||||||
| Andere Namen |
Natriumpyrosulfat | ||||||||||||||||||
| Summenformel | Na2S2O7 | ||||||||||||||||||
| Kurzbeschreibung |
farbloser, kristalliner Feststoff[1] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 222,16 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
fest | ||||||||||||||||||
| Dichte |
2,66 g·cm−3 (bei 20 °C)[2] | ||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | |||||||||||||||||||
Darstellung
BearbeitenDie chemische Verbindung mit der Summenformel Na2S2O7 entsteht beim Erhitzen von Natriumhydrogensulfat unter Wasserabspaltung:
Eine weitere Synthesemöglichkeit ist das Behandeln von Natriumsulfat mit Schwefeltrioxid.[5]
Eigenschaften
BearbeitenDie Verbindung bildet farblose, trikline[2] Kristalle, welche bei 402 °C schmelzen und sich beim Glühen zu Schwefeltrioxid und Natriumsulfat zersetzen.[5]
Natriumdisulfat reagiert als eine Lewissäure mit Wasser zu stark saurem Natriumhydrogensulfat[6]:
- .
Das Mononatriumsalz der Dischwefelsäure mit der Summenformel NaHS2O7 ist unbekannt.[7]
Toxikologie
BearbeitenFür Natriumdisulfat gibt es bisher keine GHS-Einstufung. Mit Wasser zersetzt sich Natriumdisulfat spontan und quantitativ zu Natriumhydrogensulfat[8].
Quellen
Bearbeiten- ↑ Sodium Pyrosulfate bei der Commission de la santé et de la sécurité du travail in Québec.
- ↑ a b R. Blachnik, J. D’Ans, E. Lax, C. Synowietz: Taschenbuch für Chemiker und Physiker: Band 3: Elemente, anorganische Verbindungen und Materialien, Minerale. Springer, 1998, ISBN 978-3-540-60035-0.
- ↑ S. B. Rasmussen, K. M. Eriksen, G. Hatem, F. da Silva, K. Ståhl, R. Fehrmann: Conductivity, Thermal Measurements, X-ray Investigations, and Phase Diagram of the Na2S2O7-K2S2O7 System. In: The Journal of Physical Chemistry B. 105, 2001, S. 2747–2752, doi:10.1021/jp0039262.
- ↑ Für diesen Stoff liegt noch keine harmonisierte Einstufung vor. Wiedergegeben ist eine von einer Selbsteinstufung durch Inverkehrbringer abgeleitete Kennzeichnung von Disodium disulphate im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 29. Juli 2019.
- ↑ a b R. Abegg, F. Auerbach, I. Koppel: Handbuch der anorganischen Chemie. Verlag S. Hirzel, 1908, 2. Band, 1. Teil, S. 272. Volltext
- ↑ E. Thilo, F. Von Lampe: Beiträge zur Chemie der Alkalidi(=pyro)sulfate. In: Zeitschrift für anorganische und allgemeine Chemie. Band 319, Nr. 5–6, Januar 1963, S. 387–403, doi:10.1002/zaac.19633190519.
- ↑ Recherche in der Datenbank von Chemical Abstracts vom 16. Oktober 2008.
- ↑ Reach registered factsheets, Sodium hydrogensulphate; https://echa.europa.eu/de/registration-dossier/-/registered-dossier/14458/7/4/1