Nickelformiat
Nickelformiat ist das Nickelsalz der Ameisensäure mit der Konstitutionsformel Ni(HCOO)2.
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
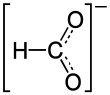 | ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Nickelformiat | |||||||||||||||
| Andere Namen |
| |||||||||||||||
| Summenformel | C2H2NiO4 | |||||||||||||||
| Kurzbeschreibung | ||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 148,73 g·mol−1 | |||||||||||||||
| Aggregatzustand |
fest[1] | |||||||||||||||
| Dichte |
2,154 g·cm−3[1] | |||||||||||||||
| Schmelzpunkt | ||||||||||||||||
| Siedepunkt |
180–200 °C (Zersetzung)[1] | |||||||||||||||
| Löslichkeit | ||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | ||||||||||||||||
Gewinnung und Darstellung
BearbeitenNickelformiat kann durch Reaktion von Nickel(II)-acetat oder Nickel(II)-hydroxid[2] mit Ameisensäure gewonnen werden.[5]
Ebenfalls möglich ist die Darstellung durch Reaktion von Natriumformiat mit Nickel(II)-sulfat.[2]
Eigenschaften
BearbeitenNickelformiat ist als Dihydrat ein grüner, geruchloser, nicht brennbarer Feststoff, der schwer löslich in Wasser ist.[1] Die Verbindung hat eine monokline Kristallstruktur.[2][6] Beim vorsichtigen Erhitzen bildet sich bei 130–140 °C das Anhydrat.[7][8] Beim Erhitzen im Vakuum auf 300 °C entsteht unter anderem reines Nickel.[5][8]
Verwendung
BearbeitenNickelformiat wird zur Herstellung von Nickel und anderer Nickelverbindungen wie Nickelkatalysatoren verwendet.[3]
Einzelnachweise
Bearbeiten- ↑ a b c d e f g h i Eintrag zu Nickeldiformat in der GESTIS-Stoffdatenbank des IFA, abgerufen am 23. Juli 2016. (JavaScript erforderlich)
- ↑ a b c d e Eintrag zu Nickel formate in der Hazardous Substances Data Bank (via PubChem), abgerufen am 29. Juni 2015.
- ↑ a b G. W. A. Milne: Gardner's Commercially Important Chemicals Synonyms, Trade Names, and Properties. John Wiley & Sons, 2005, ISBN 0-471-73661-9, S. 738 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ Eintrag zu Nickel diformate im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 1. August 2016. Hersteller bzw. Inverkehrbringer können die harmonisierte Einstufung und Kennzeichnung erweitern.
- ↑ a b John Kotz, Paul Treichel, John Townsend: Chemistry and Chemical Reactivity, Enhanced Edition. Cengage Learning, 2009, ISBN 978-0-495-39029-9, S. 335 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ Klaus Krogmann, Rainer Mattes: Die Kristallstruktur von Nickelformiat, Ni(HCOO)2 . 2H2O. In: Zeitschrift für Kristallographie - Crystalline Materials. Band 118, Nr. 1-6, 1. Dezember 1963, S. 291–302, doi:10.1524/zkri.1963.118.16.291.
- ↑ Jürgen Falbe, Manfred Regitz: RÖMPP Lexikon Chemie, 10. Auflage, 1996-1999 Band 4: M - Pk. Georg Thieme Verlag, 2014, ISBN 3-13-200031-0, S. 2238 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ a b Klaus Krogmann: Über die thermische Zersetzung von Nickelformiat. In: Zeitschrift für anorganische und allgemeine Chemie. Band 308, Nr. 1-6, März 1961, S. 226–241, doi:10.1002/zaac.19613080123.


