Peonidin-3-O-glucosid
Peonidin-3-O-glucosid ist ein Glucosid des Peonidins und gehört zur Gruppe der Anthocyane. Die Grundstruktur ist das Flavylium-Kation.
| Strukturformel | ||||||||||
|---|---|---|---|---|---|---|---|---|---|---|
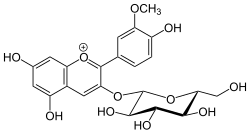
| ||||||||||
| Strukturformel des Kations. Gegenion ist nicht abgebildet | ||||||||||
| Allgemeines | ||||||||||
| Name | Peonidin-3-O-glucosidchlorid | |||||||||
| Summenformel | C22H23O11Cl | |||||||||
| Kurzbeschreibung |
violetter Feststoff[1] | |||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||
| ||||||||||
| Eigenschaften | ||||||||||
| Molare Masse | 498,87 g·mol−1 | |||||||||
| Aggregatzustand |
fest[1] | |||||||||
| Sicherheitshinweise | ||||||||||
| ||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | ||||||||||
Es ist nicht genau bekannt, welche die Gegenionen kationischer Anthocyanine in Pflanzen sind (vermutlich handelt es sich um organische Anionen), isoliert werden sie aber meist als Chloride.[2] Daher sind in der nebenstehenden Infobox Daten zu Peonidin-3-O-glucosidchlorid angegeben.
Vorkommen
BearbeitenPeonidin-3-O-glucosid ist eines der Haupt-Anthocyane in schwarzem Reis[3], kommt aber auch in Weintrauben vor.[4][5]
Eigenschaften
BearbeitenEine in-silico-Studie deutete auf mögliche entzündungshemmende Eigenschaften von Peonidin-3-O-glucosid hin.[6] Eine Studie an Medaka deutete auf positive Effekte auf die Knochenstruktur hin.[7]
Einzelnachweise
Bearbeiten- ↑ a b c d Datenblatt Peonidin-3-O-glucosidchlorid, ≥95% bei Sigma-Aldrich, abgerufen am 10. August 2023 (PDF).
- ↑ Raymond Brouillard: The in vivo expression of anthocyanin colour in plants. In: Phytochemistry. Band 22, Nr. 6, Januar 1983, S. 1311–1323, doi:10.1016/S0031-9422(00)84008-X.
- ↑ Warathit Semmarath, Sariya Mapoung, Sonthaya Umsumarng, Punnida Arjsri, Kamonwan Srisawad, Pilaiporn Thippraphan, Supachai Yodkeeree, Pornngarm Dejkriengkraikul: Cyanidin-3-O-glucoside and Peonidin-3-O-glucoside-Rich Fraction of Black Rice Germ and Bran Suppresses Inflammatory Responses from SARS-CoV-2 Spike Glycoprotein S1-Induction In Vitro in A549 Lung Cells and THP-1 Macrophages via Inhibition of the NLRP3 Inflammasome Pathway. In: Nutrients. Band 14, Nr. 13, 30. Juni 2022, S. 2738, doi:10.3390/nu14132738, PMID 35807916, PMC 9268823 (freier Volltext).
- ↑ Chi Bao Do, François Cormier: Effects of low nitrate and high sugar concentrations on anthocyanin content and composition of grape (Vitis vinifera L.) cell suspension. In: Plant Cell Reports. Band 9, Nr. 9, Januar 1991, doi:10.1007/BF00232105.
- ↑ Chi Bao Do, François Cormier: Accumulation of peonidin 3-glucoside enhanced by osmotic stress in grape (Vitis vinifera L.) cell suspension. In: Plant Cell, Tissue and Organ Culture. Band 24, Nr. 1, Januar 1991, S. 49–54, doi:10.1007/BF00044265.
- ↑ Dewi Sari, James Cairns, Anna Safitri, Fatchiyah Fatchiyah: Virtual Prediction of the Delphinidin-3-O-glucoside and Peonidin-3-O-glucoside as Anti-inflammatory of TNF- and #945; Signaling. In: Acta Informatica Medica. Band 27, Nr. 3, 2019, S. 152, doi:10.5455/aim.2019.27.152-157, PMID 31762569, PMC 6853755 (freier Volltext).
- ↑ Zhitao Ren, Nishikant A. Raut, Temitope O. Lawal, Shital R. Patel, Simon M. Lee, Gail B. Mahady: Peonidin‐3‐O ‐glucoside and cyanidin increase osteoblast differentiation and reduce RANKL ‐induced bone resorption in transgenic medaka. In: Phytotherapy Research. Band 35, Nr. 11, November 2021, S. 6255–6269, doi:10.1002/ptr.7271, PMID 34704297, PMC 8942084 (freier Volltext).