Phorbol
Phorbol ist ein Naturstoff, der von zahlreichen Pflanzen, vor allem Wolfsmilchgewächsen und Seidelbastgewächsen, produziert wird.[3] Es wurde erstmals im Jahr 1934 aus Crotonöl extrahiert.[4] Phorbol selbst ist ein relativ ungefährlicher Alkohol, jedoch sind insbesondere seine Ester toxisch und für zahlreiche Vergiftungen verantwortlich.
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
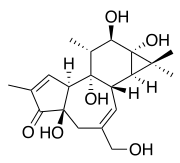
| |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Phorbol | ||||||||||||||||||
| Andere Namen |
1,1a,1b,4,4a,7a,7b,8,9,9a-Decahydro-4a,7b,9,9a-tetrahydroxy-3-(hydroxymethyl)-1,1,6,8-tetramethyl-5H-cyclopropa[3,4]benz[1,2-e]azulen-5-on | ||||||||||||||||||
| Summenformel | C20H28O6 | ||||||||||||||||||
| Kurzbeschreibung | |||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 364,44 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
fest[1] | ||||||||||||||||||
| Schmelzpunkt |
250–251 °C (Zersetzung)[2] | ||||||||||||||||||
| Siedepunkt |
572 °C (760 mmHg)[2] | ||||||||||||||||||
| Löslichkeit |
Löslich in Ethanol zu 50 mg/ml als farblose bis leicht gelbliche Lösung[2] | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | |||||||||||||||||||
Chemische Struktur und Synthese
BearbeitenPhorbol ist ein tetrazyklisches Diterpen und chemisch ähnlich zu anderen Toxinen der Wolfsmilchgewächse wie Ingenolmebutat und der Seidelbastgewächse wie Daphnetoxin und Mezerein. Wie für viele Naturstoffe ist die Totalsynthese herausfordernd, aber möglich.[5] Durch die erfolgreiche Totalsynthese ist es möglich, chemisch ähnliche Verbindungen die nicht in der Natur verfügbar sind, im Labor zu studieren und deren Potential als Wirkstoffe zu bewerten.
Natürliche Vorkommen und Extraktion
BearbeitenPhorbol wurde erstmals aus Crotonöl extrahiert, das auf Grund seiner medizinischen Anwendungen und seiner Giftigkeit einige Aufmerksamkeit auf sich gezogen hatte. Die Giftigkeit des Crotonöls wird durch achtzehn leicht verschiedene Diester des Phorbols verursacht[6][7][8], die durch Auswaschen mit Methanol und anschließende Aufreinigung extrahiert werden können.[9]
Phorbolester haben einen substantiellen Beitrag zur Giftigkeit des Manchinelbaums und seiner Früchte, der Manzanilla de la muerte (Äpfelchen des Todes).[10][11]
Vergiftungserscheinungen
BearbeitenPhorbolester wie beispielsweise Phorbol-12-myristat-13-acetat imitieren 1,2-Diacylglycerine, einen Aktivator der Proteinkinase C. Diese Proteinkinase ist eine Schlüsselkomponente der zelluläre Signaltransduktion, die dadurch massiv gestört wird.[12][13]
Pflanzen mit höheren Gehalten an Phorbolestern sind problematische Futtermittel in der Tiermast von Pflanzenfressern.[14] Vergiftungen bei Menschen sind durch Honig[15] oder den Konsum von phorbolhaltigen Pflanzenteilen bekannt.[11]
Grundlagenforschung
BearbeitenZahlreiche Ester des Phorbols haben biologisch bemerkenswerte Eigenschaften. In der Grundlagenforschung werden sie zur Induktion von Tumoren[12] und zur Verstärkung der Ausschüttung von Neurotransmittern verwendet.[13]
Einzelnachweise
Bearbeiten- ↑ a b c d Datenblatt Phorbol bei Sigma-Aldrich, abgerufen am 1. März 2017 (PDF).
- ↑ a b c d Datenblatt Phorbol bei Alfa Chemistry, abgerufen am 1. März 2017.
- ↑ G. Goel, H. P. Makkar, G. Francis, K. Becker: Phorbol esters: structure, biological activity, and toxicity in animals. In: International Journal of Toxicology. Band 26, Nummer 4, 2007 Jul-Aug, S. 279–288; doi:10.1080/10915810701464641, PMID 17661218 (Review).
- ↑ B. Flaschenträger, R. Wolffersdorff: Über den Giftstoff des Crotonöles. In: Helvetica Chimica Acta. Band 17, Nummer 1, 1934, S. 1444–1452; doi:10.1002/hlca.193401701179.
- ↑ S. Kawamura, H. Chu, J. Felding, P. S. Baran: Nineteen-step total synthesis of (+)-phorbol. In: Nature. Band 532, Nummer 7597, April 2016, S. 90–93; doi:10.1038/nature17153, PMID 27007853, PMC 4833603 (freier Volltext).
- ↑ W. Blaschek, R. Hänsel, K. Keller: Hagers Handbuch der Pharmazeutischen Praxis. Folgeband 2: Drogen A–K, 5. Auflage, Springer, 1998, ISBN 978-3-642-63794-0, S. 471–476, eingeschränkte Vorschau in der Google-Buchsuche.
- ↑ E. Hecker: Phorbol esters from croton oil. Chemical nature and biological activities. In: Die Naturwissenschaften. Band 54, Nummer 11, Juni 1967, S. 282–284; PMID 5589922.
- ↑ J. G. Meyer-Bertenrath: 150 Years of croton oil research. In: Experientia. Band 25, Nummer 1, Januar 1969, S. 1–5; PMID 4885798.
- ↑ B. Flaschenträger, G. Wigner: Über den Giftstoff des Crotonöles. V. Die Gewinnung von Crotonharz, Dünnem Öl und Phorbol aus dem Crotonöl durch Alkoholyse. In: Helvetica Chimica Acta. Band 25, Nummer 3, 1942, S. 569–581; doi:10.1002/hlca.19420250315.
- ↑ W. Adolf, E. Hecker: On the active principles of the spurge family, X. Skin irritants, cocarcinogens, and cryptic cocarcinogens from the latex of the manchineel tree. In: Journal of Natural Products. Band 47, Nummer 3, 1984 May-Jun, S. 482–496; PMID 6481361.
- ↑ a b N. H. Strickland: Eating a manchineel "beach apple" In: BMJ. Band 321, Nummer 7258, August 2000, S. 428; PMID 10938053, PMC 1127797 (freier Volltext).
- ↑ a b P. M. Blumberg: Protein kinase C as the receptor for the phorbol ester tumor promoters: sixth Rhoads memorial award lecture. In: Cancer Research. Band 48, Nummer 1, Januar 1988, S. 1–8; PMID 3275491 (Review).
- ↑ a b E. M. Silinsky, T. J. Searl: Phorbol esters and neurotransmitter release: more than just protein kinase C? In: British Journal of Pharmacology. Band 138, Nummer 7, April 2003, S. 1191–1201; doi:10.1038/sj.bjp.0705213, PMID 12711617, PMC 1573789 (freier Volltext) (Review).
- ↑ G. Goel, H. P. Makkar, G. Francis, K. Becker: Phorbol esters: structure, biological activity, and toxicity in animals. In: International Journal of Toxicology. (2007), Band 26, Ausgabe 4, S. 279–288; PMID 17661218.
- ↑ S. Sosath, H. H. Ott, E. Hecker: Irritant principles of the spurge family (Euphorbiaceae). XIII. Oligocyclic and macrocyclic diterpene esters from latices of some Euphorbia species utilized as source plants of honey. In: Journal of Natural Products. Band 51, Nummer 6, 1988 Nov-Dec, S. 1062–1074; PMID 3236005.
