Plutonium(III)-fluorid
Plutonium(III)-fluorid ist eine chemische Verbindung aus den Elementen Plutonium und Fluor. Es besitzt die Formel PuF3 und gehört zur Stoffklasse der Fluoride.
| Kristallstruktur | ||||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| ||||||||||
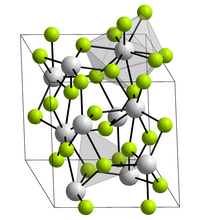
| _ Pu3+ _ F− | ||||||||||
| Kristallsystem | ||||||||||
| Raumgruppe |
P3c1 (Nr. 165) | |||||||||
| Gitterparameter | ||||||||||
| Koordinationszahlen |
Pu[9], F[3] | |||||||||
| Allgemeines | ||||||||||
| Name | Plutonium(III)-fluorid | |||||||||
| Andere Namen |
Plutoniumtrifluorid | |||||||||
| Verhältnisformel | PuF3 | |||||||||
| Kurzbeschreibung |
violette Kristalle[1] | |||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||
| ||||||||||
| Eigenschaften | ||||||||||
| Molare Masse | 301,06 g·mol−1 | |||||||||
| Aggregatzustand |
fest | |||||||||
| Dichte |
9,33 g·cm−3[2] | |||||||||
| Schmelzpunkt | ||||||||||
| Siedepunkt |
1957 °C[1] | |||||||||
| Löslichkeit |
nahezu unlöslich in Wasser[3] | |||||||||
| Gefahren- und Sicherheitshinweise | ||||||||||
 Radioaktiv | ||||||||||
| ||||||||||
| Thermodynamische Eigenschaften | ||||||||||
| ΔHf0 | ||||||||||
| Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | ||||||||||
Darstellung
BearbeitenPlutonium(III)-fluorid ist schwerlöslich und entsteht durch die Umsetzung einer wässrigen Plutonium(III)-nitratlösung mit Fluoridsalzen im Sauren.[5]
Plutonium(III)-fluorid kann auch durch Reaktion von Plutonium(IV)-oxalat und Wasserstoff, Plutonium(III)-oxalat oder Plutonium(IV)-oxid mit Fluorwasserstoff gewonnen werden.[3]
Eigenschaften
BearbeitenPlutonium(III)-fluorid bildet violette Kristalle mit einem Schmelzpunkt von 1396 °C.[1] Es kristallisiert in der Lanthanfluoridstruktur mit den Gitterparametern a = 709,3 pm und c = 725,4 pm.[1] Hierbei ist jeder Plutoniumkern von neun Fluorkernen in einer verzerrten dreifach-überkappten trigonal-prismatischen Struktur umgeben. Es ist sublimierbar und hat eine größere Flüchtigkeit als Americium(III)-fluorid.[6][7]
Verwendung
BearbeitenUm Plutonium zur Wiederaufbereitung durch Ausfällung aus Lösungen abtrennen zu können, wurde eine Methode zur Ausfällung als Plutonium(III)-fluorid entwickelt, um eine Alternative zur bisherigen Plutoniumperoxidmethode zu haben.[8] Eine Studie des Los Alamos National Laboratory aus dem Jahr 1957 berichtet, dass diese Methode gegenüber dem bisherigen Verfahren weniger effektiv sei,[9] während eine neuere Studie, die vom US-Office of Scientific and Technical Information in Auftrag gegeben wurde, diese als eine eher effektivere Methode darstellt.[10][11]
Sicherheitshinweise
BearbeitenEinstufungen nach der CLP-Verordnung liegen nicht vor, obwohl die chemische Giftigkeit bekannt ist. Wichtig sind die auf der Radioaktivität beruhenden Gefahren, sofern es sich um eine dafür relevante Stoffmenge handelt.
Einzelnachweise
Bearbeiten- ↑ a b c d e f g Gmelins Handbuch der anorganischen Chemie, System Nr. 71, Transurane, Teil C, S. 101–104.
- ↑ David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press / Taylor and Francis, Boca Raton FL, Properties of the Elements and Inorganic Compounds, S. 4-81.
- ↑ a b Georg Brauer (Hrsg.): Handbuch der Präparativen Anorganischen Chemie. 3., umgearb. Auflage. Band II. Enke, Stuttgart 1978, ISBN 3-432-87813-3, S. 1299.
- ↑ Die von der Radioaktivität ausgehenden Gefahren gehören nicht zu den einzustufenden Eigenschaften nach der GHS-Kennzeichnung. In Bezug auf weitere Gefahren wurde dieser Stoff entweder noch nicht eingestuft oder eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- ↑ G. A. Burney, F. W. Tober: Precipitation of Plutonium Trifluoride, in: Ind. Eng. Chem. Process Des. Dev., 1965, 4 (1), S. 28–32 (doi:10.1021/i260013a009).
- ↑ Stephen C. Carniglia, B. B. Cunningham: Vapor Pressures of Americium Trifluoride and Plutonium Trifluoride, Heats and Free Energies of Sublimation, in: J. Am. Chem. Soc., 1955, 77 (6), S. 1451–1453 (doi:10.1021/ja01611a015).
- ↑ P. D. Kleinschmidt: Sublimation Studies of Plutonium Trifluoride, in: Journal of Nuclear Materials, 1989, 167, S. 131–134 (doi:10.1016/0022-3115(89)90434-0).
- ↑ C. K. Gupta: Hydrometallurgy in Extraction Processes. CRC Press, 1990, ISBN 978-0-8493-6805-9, S. 206–208 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ R. S. Winchester: Aqueous Decontamination of Plutonium from Fission Product Elements. Los Alamos Scientific Laboratory of the University of California, 1957, S. 9–10 (fas.org [PDF; abgerufen am 20. Juni 2008]).
- ↑ L. L. Martella, M. T. Saba, G. K. Campbell: Laboratory-scale evaluations of alternative plutonium precipitation methods. United States Office of Scientific and Technical Information, 1984 (osti.gov [abgerufen am 20. Juni 2008]).
- ↑ K. F. Grebenkin, Yu. N. Zuev, L. N. Lokhtin, N. A. Novoselov, A. V. Panov, V. A. Simonenko, V. G. Subbotin, V. M. Berezkin, E. N. Zvonarev, O. I. Kozlov, V. I. Lobanov, V. P. Mashirev, V. V. Shatalov, A. D. Maksimov, D. Yu. Chuvilin: Synthesis of Plutonium Trifluoride from Weapons – Plutonium as a Potential Fuel for Power Reactors, in: Atomic Energy, 1997, 83 (2), S. 614–621 (doi:10.1007/BF02413891).
Literatur
Bearbeiten- David L. Clark, Siegfried S. Hecker, Gordon D. Jarvinen, Mary P. Neu: Plutonium, in: Lester R. Morss, Norman M. Edelstein, Jean Fuger (Hrsg.): The Chemistry of the Actinide and Transactinide Elements, Springer, Dordrecht 2006; ISBN 1-4020-3555-1, S. 813–1264 (doi:10.1007/1-4020-3598-5_7).