Prenylacetat
Prenylacetat ist ein Carbonsäureester, der sich aus Prenylalkohol und Essigsäure durch Veresterung bildet.
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
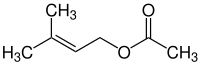
| |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Prenylacetat | ||||||||||||||||||
| Andere Namen |
3-Methyl-2-butenylacetat | ||||||||||||||||||
| Summenformel | C7H12O2 | ||||||||||||||||||
| Kurzbeschreibung |
farblose Flüssigkeit mit fruchtigem Geruch[1] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 128,17 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
flüssig[1] | ||||||||||||||||||
| Dichte |
0,91 g·cm−3 (20 °C)[1] | ||||||||||||||||||
| Siedepunkt |
149 °C[1] | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | |||||||||||||||||||
Vorkommen
BearbeitenDas ätherische Öl der Römischen Kamille enthält etwa 1,4 % Prenylacetat.[2] Es wurde außerdem in Propolis[3][4], Rosen[5], Bananen[6], dem Palmfarn Macrozamia miquelli (Gattung Macrozamia)[7], der Strauß-Narzisse[8] und Pepino[9] nachgewiesen. In geringer Menge ist es in der Chinesischen Zwergkirsche (Cerasus humilis) enthalten.[10]
Herstellung
BearbeitenPrenylacetat kann durch Acetylierung von Prenylalkohol mit Acetylchlorid in Gegenwart einer Base (z. B. Triethylamin) hergestellt werden.[11]
Eigenschaften
BearbeitenIn einer Studie wirkte die Verbindung abschreckend gegen Feuerameisen (Solenopsis invicta).[12]
Verwendung
BearbeitenPrenylacetat mit einer Reinheit von mindestens 95 % ist in der EU unter der FL-Nummer 09.692 als Aromastoff für Lebensmittel allgemein zugelassen.[13]
In der organischen Synthese kann Prenylacetat als Edukt für die Herstellung von Boronsäuren dienen, die eine Prenylgruppe tragen. Diese wiederum können zu Prenylierung von Aromaten über eine Suzuki-Kupplung verwendet werden.[14] Es wurde auch schon für die Synthese von Terpen-Vorstufen[15] und von Vitamin A verwendet.[16]
Einzelnachweise
Bearbeiten- ↑ a b c d e f Eintrag zu 3-Methyl-2-butenylacetat in der GESTIS-Stoffdatenbank des IFA, abgerufen am 10. Januar 2025. (JavaScript erforderlich)
- ↑ Stefanie Bail, Gerhard Buchbauer, Leopold Jirovetz, Zapriana Denkova, Alexander Slavchev, Albena Stoyanova, Erich Schmidt, Margit Geissler: Antimicrobial Activities of Roman Chamomile Oil From France and Its Main Compounds. In: Journal of Essential Oil Research. Band 21, Nr. 3, Mai 2009, S. 283–286, doi:10.1080/10412905.2009.9700171.
- ↑ Guy Kamatou, Maxleene Sandasi, Sidonie Tankeu, Sandy van Vuuren, Alvaro Viljoen: Headspace analysis and characterisation of South African propolis volatile compounds using GCxGC–ToF–MS. In: Revista Brasileira de Farmacognosia. Band 29, Nr. 3, Mai 2019, S. 351–357, doi:10.1016/j.bjp.2018.12.002.
- ↑ Lina G Mohtar, Sergio A Rodríguez, Mónica A Nazareno: Comparative analysis of volatile compound profiles of propolis from different provenances: volatile compound profiles of propolis. In: Journal of the Science of Food and Agriculture. Band 98, Nr. 9, Juli 2018, S. 3409–3415, doi:10.1002/jsfa.8852.
- ↑ Mohammed Ibrahim, Manjree Agarwal, Jeong Oh Yang, Muslim Abdulhussein, Xin Du, Giles Hardy, Yonglin Ren: Plant Growth Regulators Improve the Production of Volatile Organic Compounds in Two Rose Varieties. In: Plants. Band 8, Nr. 2, 31. Januar 2019, S. 35, doi:10.3390/plants8020035, PMID 30709057, PMC 6410221 (freier Volltext).
- ↑ Subhadip Mukherjee, Ambika Goswami, Debashis Mandal, Adinpunya Mitra: Variation in postharvest fruit aroma volatiles among two popular banana cv. Malbhog and cv. Vaibalhla of north-eastern region in India. In: Plant Physiology Reports. Band 27, Nr. 2, Juni 2022, S. 225–233, doi:10.1007/s40502-022-00655-y.
- ↑ L. Irene Terry, Chris J. Moore, Robert B. Roemer, Dean R. Brookes, Gimme H. Walter: Unique chemistry associated with diversification in a tightly coupled cycad-thrips obligate pollination mutualism. In: Phytochemistry. Band 186, Juni 2021, S. 112715, doi:10.1016/j.phytochem.2021.112715.
- ↑ Hsin-Chun Chen, Hai-Shan Chi, Li-Yun Lin: Headspace Solid-Phase Microextraction Analysis of Volatile Components in Narcissus tazetta var. chinensis Roem. In: Molecules. Band 18, Nr. 11, 6. November 2013, S. 13723–13734, doi:10.3390/molecules181113723, PMID 24201208, PMC 6269655 (freier Volltext).
- ↑ Haruyasu Shiota, Harry Young, Vivienne J Paterson, Mamoru Irie: Volatile aroma constituents of pepino fruit. In: Journal of the Science of Food and Agriculture. Band 43, Nr. 4, 1988, S. 343–354, doi:10.1002/jsfa.2740430407.
- ↑ Liqin Ye, Chunxiang Yang, Weidong Li, Jiangbo Hao, Meng Sun, Jingru Zhang, Zhongshuang Zhang: Evaluation of volatile compounds from Chinese dwarf cherry (Cerasus humilis (Bge.) Sok.) germplasms by headspace solid-phase microextraction and gas chromatography–mass spectrometry. In: Food Chemistry. Band 217, Februar 2017, S. 389–397, doi:10.1016/j.foodchem.2016.08.122.
- ↑ Qiaoxin Xiao, Lili Jiang, Yan Liang, Kaili Wang, Wenjun Lin, Guiling Shi, Xuming Wang, Haoran Li, Congmin Wang: Tuning the Basicity for Highly Efficient and Reversible Hydrogen Chloride Absorption to Develop a Green Acid Scavenger. In: ACS Sustainable Chemistry & Engineering. Band 10, Nr. 7, 21. Februar 2022, S. 2289–2293, doi:10.1021/acssuschemeng.1c08464.
- ↑ Yuzhe Du, Aiming Zhou, Jian Chen: Olfactory and behavioral responses to acetate esters in red imported fire ant, Solenopsis invicta. In: Pest Management Science. Band 77, Nr. 3, März 2021, S. 1371–1382, doi:10.1002/ps.6152.
- ↑ Food and Feed Information Portal Database | FIP. Abgerufen am 25. August 2023.
- ↑ Darío C. Gerbino, Sandra D. Mandolesi, Hans-Günther Schmalz, Julio C. Podestá: Introduction of Allyl and Prenyl Side-Chains into Aromatic Systems by Suzuki Cross-Coupling Reactions. In: European Journal of Organic Chemistry. Band 2009, Nr. 23, August 2009, S. 3964–3972, doi:10.1002/ejoc.200900234.
- ↑ Shigeaki Suzuki, Yoshiji Fujita, Yuichi Kobayashi, Fumie Sato: A Convenient Preparative Route to 1,2-Epoxy-3-Methyl-3-Butene Via Ene-Type Chlorination. In: Synthetic Communications. Band 16, Nr. 5, April 1986, S. 491–497, doi:10.1080/00397918608078762.
- ↑ Percy S. Manchand, Harry S. Wong, John F. Blount: Synthesis of vitamin A and related compounds via a π-allylpalladium complex. In: The Journal of Organic Chemistry. Band 43, Nr. 25, Dezember 1978, S. 4769–4774, doi:10.1021/jo00419a014.
