Rubidiumoxalat
Rubidiumoxalat ist das Rubidiumsalz der Oxalsäure.
| Strukturformel | |||||||
|---|---|---|---|---|---|---|---|
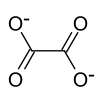
| |||||||
| Allgemeines | |||||||
| Name | Rubidiumoxalat | ||||||
| Summenformel | Rb2C2O4 | ||||||
| Kurzbeschreibung |
farblose, glanzlose Kristalle[1] | ||||||
| Externe Identifikatoren/Datenbanken | |||||||
| |||||||
| Eigenschaften | |||||||
| Molare Masse | |||||||
| Aggregatzustand |
fest | ||||||
| Dichte |
2,76 g·cm−3[1] (Monohydrat) | ||||||
| Schmelzpunkt |
Zersetzung[2] | ||||||
| Sicherheitshinweise | |||||||
| |||||||
| Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | |||||||
Herstellung
BearbeitenRubidiumoxalat kann aus Rubidiumcarbonat und Oxalsäure hergestellt werden.[4]
Es entsteht auch bei der thermischen Zersetzung von Rubidiumformiat.[5]
Eigenschaften
BearbeitenRubidiumoxalat kristallisiert als Monohydrat (COO)2Rb2 im monoklinen Kristallsystem.[1] und ist isomorph zum Kaliumoxalat-Monohydrat.[6] Vom Anhydrat existieren bei Raumtemperatur zwei Modifikationen: Eine Modifikation ist monoklin und isotyp zu Caesiumoxalat, die andere ist orthorhombisch und isotyp zum Kaliumoxalat.[7] Frisch hergestelltes wasserfreies Rubidiumoxalat enthält zunächst hauptsächlich die monokline Phase, diese wandelt sich jedoch langsam irreversibel in die orthorhombische Modifikation um.[2] 2004 wurden zwei weitere Hochtemperaturphasen von Rubidiumoxalat entdeckt.[8]
Kristalldaten der verschiedenen Modifikationen von Rubidiumoxalat:
| Modifikation | Kristallsystem | Raumgruppe | a in Å | b in Å | c in Å | β | Z |
|---|---|---|---|---|---|---|---|
| Alpha[7] | monoklin | P21/c | 6,328 | 10,455 | 8,217 | 98,016° | 4 |
| Beta[7] | orthorhombisch | Pbam | 11,288 | 6,295 | 3,622 | — | 2 |
| Monohydrat[9] | monoklin | C2/c | 9,617 | 6,353 | 11,010 | 109,46° | 4 |
Die Standardbildungsenthalpie des kristallinen Rubidiumoxalates beträgt 1325,0 ± 8,1 kJ/mol.[10]
Die Zersetzung von Rubidiumoxalat unter Freisetzung von Kohlenmonoxid sowie in weiterer Folge Kohlendioxid und Sauerstoff findet bei 507–527 °C statt.[2][5]
Neben dem neutralen Rubidiumoxalat existiert auch ein Hydrogenoxalat mit der Formel RbH(COO)2, das isomorph zu entsprechenden Kaliumverbindung ist[11] und monokline Kristalle bildet,[12] sowie ein saures Tetraoxalat mit der Formel RbH3(COO)4, das als Dihydrat kristallisiert, bei 18 °C eine Dichte von 2,125 g/cm3 und bei 21 °C eine Löslichkeit von 21 g/l besitzt.[13]
Rubidiumoxalat bildet beim Eindampfen einer Lösung in Wasserstoffperoxid ein Monoperhydrat der Zusammensetzung (COO)2Rb2·H2O2, das monokline Kristalle bildet, die an der Luft relativ stabil sind.[14]
Mit Fluorwasserstoff reagiert Rubidiumoxalat unter Bildung einer Komplexverbindung.[15]
Einzelnachweise
Bearbeiten- ↑ a b c Jean D’Ans, Ellen Lax: Taschenbuch für Chemiker und Physiker. 3. Elemente, anorganische Verbindungen und Materialien, Minerale, Band 3. 4. Auflage, Springer, 1997, ISBN 978-3-540-60035-0, S. 686f. (eingeschränkte Vorschau in der Google-Buchsuche)
- ↑ a b c Dissertation: "Konformationsaufklärung anorganischer Oxoanionen des Kohlenstoffs", Sascha Vensky, Universität Stuttgart, 2004. S. 117ff. PDF
- ↑ Dieser Stoff wurde in Bezug auf seine Gefährlichkeit entweder noch nicht eingestuft oder eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- ↑ E. Giglio, S. Loreti, N. V. Pavel: "EXAFS: A New Approach to the Structure of Micellar Aggregates" in J. Phys. Chem., 1988, 92, S. 2858–2862. doi:10.1021/j100321a032
- ↑ a b T. Meisel, Z. Halmos, K. Seybold, E. Pungor: "The thermal decomposition of alkali metal formates" in Journal of Thermal Analysis and Calorimetry 1975, 7(1). S. 73–80. doi:10.1007/BF01911627
- ↑ Björn Pedersen: "The Equilibrium Hydrogen-Hydrogen Distances in the Water Molecules in Potassium and Rubidium Oxalate Monohydrates" in Acta Cryst., 1966, 20, S. 412ff. doi:10.1107/S0365110X66000951
- ↑ a b c R. E. Dinnebier, S. Vensky, M. Panthöfer, M. Jansen: "Crystal and molecular structures of alkali oxalates: first proof of a staggered oxalate anion in the solid state." in Inorg. Chem, 2003, 42(5), S. 1499–1507. PMID 12611516.
- ↑ Robert E. Dinnebier, Sascha Vensky, Martin Jansen, Jonathan C. Hanson: Crystal Structures and Topological Aspects of the High‐Temperature Phases and Decomposition Products of the Alkali‐Metal Oxalates M2[C2O4] (M=K, Rb, Cs). In: Chemistry - A European Journal. Band 11, Nr. 4, 4. Februar 2005, S. 1119–1129, doi:10.1002/chem.200400616.
- ↑ Takuya Echigo, Mitsuyoshi Kimata: The common role of water molecule and lone electron pair as a bond-valence mediator in oxalate complexes : the crystal structures of Rb2(C2O4) · H2O and Tl2(C2O4). In: Zeitschrift für Kristallographie. Band 221, Nr. 12, November 2006, S. 762–769, doi:10.1524/zkri.2006.221.12.762.
- ↑ Y. Masuda, H. Miyamoto, Y. Kaneko, K. Hirosawa: "The standard molar enthalpies of formation of crystalline rubidium and cesium oxalates" in J. Chem. Thermodynamics, 1985, 17(2), S. 159–164. doi:10.1016/0021-9614(85)90068-0
- ↑ J. Piccard: "Beitrag zur Kenntniss der Rubidiumverbindungen" in Journal für Praktische Chemie 1862, 86(1), S. 449–460. doi:10.1002/prac.18620860163 Volltext
- ↑ H. Watts: "A dictionary of chemistry and the allied branches of other sciences", Band 4, Verlag Longmans, Green and Co., 1866, S. 264. (eingeschränkte Vorschau in der Google-Buchsuche)
- ↑ R. Abegg, F. Auerbach: "Handbuch der anorganischen Chemie". Verlag S. Hirzel, Bd. 2, 1908. S. 435. Volltext
- ↑ B. F. Pedersen: "The Crystal Structure of Potassium and Rubidium Oxalate Monoperhydrates, K2C2O4.H2O2 and Rb2C2O4.H2O2" in Acta Chem. Scand. 1967, 21, S. 779–790. doi:10.3891/acta.chem.scand.21-0779.
- ↑ R. F. Weinland, W. Stille: "Ueber die Anlagerung von Krystallfluorwasserstoff an Oxalate und an Ammoniumtartrat" in Justus Liebigs Annalen der Chemie 1903, 328(2), S. 149–153. doi:10.1002/jlac.19033280205.