Silberoxalat
chemische Verbindung
Silberoxalat ist das Silbersalz der Oxalsäure.
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
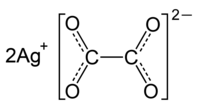
| |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Silberoxalat | ||||||||||||||||||
| Andere Namen |
| ||||||||||||||||||
| Summenformel | Ag2C2O4 | ||||||||||||||||||
| Kurzbeschreibung |
farblose Kristalle[1] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 303,75 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
fest[1] | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | |||||||||||||||||||
Gewinnung und Darstellung
BearbeitenDas Salz wird durch Ausfällen einer Silbernitratlösung mit Oxalsäure bei 40 °C hergestellt:[3]
Anschließend wird es im Vakuum über Phosphorpentoxid getrocknet.[3]
Eigenschaften
BearbeitenSilberoxalat zerfällt bei 125 °C[3] zu metallischen Silber und Kohlenstoffdioxid:[4]
Einzelnachweise
Bearbeiten- ↑ a b D. Yu. Naumov, A. V. Virovets, N. V. Podberezskaya, E. V. Boldyreva: Silver Oxalate, 2 Ag+C2O42-. In: Acta Crystallographica. 1995, doi:10.1107/S0108270194008188.
- ↑ Für diesen Stoff liegt noch keine harmonisierte Einstufung vor. Wiedergegeben ist eine von einer Selbsteinstufung durch Inverkehrbringer abgeleitete Kennzeichnung von Disilver oxalate im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 22. Dezember 2024.
- ↑ a b c F. C. Tompkins: The thermal decomposition of silver oxalate. In: Transactions of the Faraday Society. 1948, doi:10.1039/TF9484400206.
- ↑ V.V. Boldyrev: Thermal decomposition of silver oxalate. In: Thermochimica Acta. Band 338, 2002, S. 63–90, doi:10.1016/S0040-6031(02)00044-8.


