Spartein
Spartein [genauer (−)-Spartein, L-Spartein; auch Lupinidin] ist ein Naturstoff aus der Gruppe der Lupinen-Alkaloide. Es wirkt anregend auf Herz, Kreislauf und Darm und steigert die Diurese. Spartein ist für den Menschen giftig und kann zum Tod durch Kreislaufkollaps führen.
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
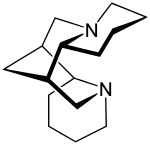
| |||||||||||||||||||
| Strukturformel von (−)-Spartein | |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Freiname | Spartein | ||||||||||||||||||
| Andere Namen |
| ||||||||||||||||||
| Summenformel | C15H26N2 | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Arzneistoffangaben | |||||||||||||||||||
| ATC-Code | |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 234,38 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
fest | ||||||||||||||||||
| Dichte |
1,02 g·cm−3[1] | ||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Siedepunkt | |||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Toxikologische Daten | |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | |||||||||||||||||||
Das Enantiomer (+)-Spartein, auch Pachycarpin genannt, kommt nur selten vor. Deswegen ist mit „Spartein“ – wenn nicht anders angegeben – stets das (−)-Spartein gemeint.
Vorkommen
Bearbeiten(−)-Spartein findet sich beispielsweise im Besenginster und Schöllkraut. In den Samen der gelben Lupine (Lupinus luteus) besteht der Alkaloidanteil zu 30–50 % aus Spartein.[3]
Seit einigen Jahren wird über Probleme bei der kommerziellen Verfügbarkeit von (−)-Spartein berichtet, wodurch die Preise erheblich gestiegen sind. Im Zusammenhang damit ist auch die Forschung der früher leicht und kostengünstig zugänglichen chiralen Chemikalie stark zurückgegangen.[4]
(+)-Spartein (Pachycarpin) ist deutlich seltener, es ist sehr toxisch und kommt in verschiedenen Hülsenfrüchtlern vor,[5] z. B. in der US-amerikanischen Lupinenart Lupinus pusillus.[6]
Historisches
BearbeitenSpartein wurde von John Stenhouse entdeckt, der es durch Säureextraktion und Destillation aus dem Besenginster (lat. auch Spartium scoparium) erhielt und die Entdeckung 1850/1851 beschrieb.[7][8][9] Er beschrieb es als flüchtige organische Base und als farbloses Öl, deutlich dichter als Wasser, mit einem schwachen, dem Anilin ähnlichen Geruch und einem bitteren Geschmack. Spartein wurde in Form von Sparteinsulfat schon seit 1873 zur Behandlung von Herzkrankheiten verwendet.[10] Seit 1939 diente es als Wehenmittel.[11] Noch in den 1980er Jahren galt es als verlässliches und sicher wirksames Antiarrhythmikum der ersten Wahl für die Notfallmedizin, und als zuverlässiges Wehenmittel.[10]
Die ersten Totalsynthesen von Spartein wurden 1948 bekanntgegeben.[12][13][14] Die ersten Synthesen erforderten eine Racematspaltung. Die erste asymmetrische Totalsynthese des (+)-Spartein-Isomers nutzt eine Variante der Beckmann-Umlagerung und wurde 2002 veröffentlicht.[15]
In den 1950er Jahren wurden Spartein-Komplexsalze (als Präparat Perivar von Curta & Co. GmbH) zur Behandlung von venenbedingten Symptomen wie Krampfaderbeschwerden, Thrombophlebitis, Hämorrhoiden und Muskelkrämpfen angeboten.[16]
Eigenschaften
BearbeitenIn kaltem Wasser ist Spartein kaum löslich. Die Lösung reagiert deutlich alkalisch.[7][9] Es löst sich leicht in Ethanol, Diethylether, Dichlormethan und Chloroform. Spartein ist in Benzin (Petrolether oder Ligroin) und Benzol unlöslich.[17] Es ist an Licht und Luft instabil und verfärbt sich gelblich bis braun. Spartein riecht ähnlich wie Anilin und schmeckt intensiv bitter.
Die oral letale Dosis beträgt für Mäuse 220 mg/kg Körpergewicht.
Strukturell ist das Spartein durch ein überbrücktes Ringsystem und vier chirale C-Atome charakterisiert: Im Zentrum befindet sich ein symmetrischer Heterocyclus, der durch eine Methylengruppe überbrückt wird. An zwei Seiten ist je ein weiterer Ring (A und D) anelliert, so dass ein Tetracyclus resultiert. Neben dem Enantiomer (+)-Spartein existieren als Epimere zu Spartein ferner das α-Isospartein (C-11-Epimer) und β‑Isospartein (C-6-Epimer).[5]
| Natürlich vorkommende[18] Isomere | Strukturformel | Stereochemische Anordnung | Stellung der Ringe A/B-C/D |
| (−)-Spartein (Lupinidin) | 6R,7S,9S,11S | cis-trans (exo/endo) | |
| (+)-Spartein (Pachycarpin)[19] | 6S,7R,9R,11R | ||
| (−)-α-Isospartein (Genistein) | 6R,7S,9S,11R | cis-cis (endo/endo) | |
| (−)-β‑Isospartein (Pusillin, Spartalupin) | 6R,7R,9R,11R | trans-trans (exo/exo) |
Biosynthese des Sparteins
BearbeitenDas tetracyclische Spartein wird bei der Biosynthese aus der Aminosäure L-Lysin aufgebaut. Dabei werden zunächst aus drei Molekülen L-Lysin drei Moleküle Cadaverin gebildet. Im Verlauf der weiteren Reaktionen nehmen vier Moleküle Pyruvat vier der Amin-Gruppen auf; es entstehen vier Moleküle Alanin. Die Biosynthese erfolgt in Chloroplasten; danach werden die Alkaloide in die übrigen Pflanzenteile transportiert, insbesondere in die reifenden Früchte.[20]
Verwendung
BearbeitenSparteinsulfat wurde als Antiarrhythmikum, d. h. zur Behandlung von Herzrhythmusstörungen, verwendet. Es konnte bei schwerwiegenden symptomatischen Tachykardien verabreicht werden, wenn diese nach der Beurteilung des Arztes lebensbedrohend sind.[21] Die Antiarrhythmika der Klasse I werden aber kaum mehr verwendet. Spartein wurde früher auch in der Geburtshilfe eingesetzt. Allerdings traten dabei bei einigen Fällen ungewöhnlich heftige Wehen auf, die in einigen Fällen zum Tode des Fetus führten.[22] Diese Arzneimittelnebenwirkung ist durch erbliche Polymorphismen erklärt worden.[23] Spartein dient in der biomedizinischen Forschung als Modellsubstanz zum Studium dieses Polymorphismus, der die Oxidation von Stoffen durch das Cytochrom P450 betrifft.[24]
Spartein kann analog zum Bispidin mit seinen beiden Stickstoffatomen als zweizähniger Ligand dienen. Im Gegensatz zu Bispidin ist Spartein chiral. (−)-Spartein wird als effektives Hilfsmittel in der enantioselektiven Synthese verwendet.[25]
Pachycarpin wird in der GUS arzneilich zur Behandlung hypertoner Krisen, von Spasmen der peripheren Gefäße und bei Myopathien angewendet.[26]
Sparteinsulfat
BearbeitenSparteinsulfat (Sparteinum sulfuricum, schwefelsaures Spartein) bildet farblose, nadelförmige Kristalle. Sie sind – im Gegensatz zum Spartein selbst – in Wasser leicht löslich und es bildet sich eine neutrale Lösung. Außerdem ist Sparteinsulfat in Alkohol löslich, aber nicht in Chloroform.
Weblinks
BearbeitenEinzelnachweise
Bearbeiten- ↑ a b c d e Datenblatt (−)-Sparteine bei Sigma-Aldrich, abgerufen am 23. April 2011 (PDF).
- ↑ a b David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press / Taylor and Francis, Boca Raton FL, Physical Constants of Organic Compounds, S. 3-462.
- ↑ Michael Wink, Methoden zum Nachweis von Lupinen-Alkaloiden ( vom 5. Februar 2016 im Internet Archive)
- ↑ Stephen K. Ritter: Where has all the sparteine gone? | April 24, 2017 Issue - Vol. 95 Issue 17 | Chemical & Engineering News. Abgerufen am 22. Juli 2019.
- ↑ a b H. J. Roth: Symmetrische Alkaloide*. In: Deutsche Apothekerzeitung. Band 18, 2010 (deutsche-apotheker-zeitung.de).
- ↑ Léo Marion, Stuart W. Fenton: The Papilionaceous Alkaloids. VI. Lupinus Pusillus, Pursh. In: ACS (Hrsg.): The Journal of Organic Chemistry (JOC). Band 13, Nr. 5, September 1948, S. 780–781, doi:10.1021/jo01163a025.
- ↑ a b John Stenhouse: On the Action of Nitric Acid on Various Vegetables, with a More Particular Examination of Spartium scoparium, Linn., or Common Broom. In: The Royal Society (Hrsg.): Philosophical Transactions R. Soc. Lond. Band 141. London 1. Januar 1851, S. 413–431, doi:10.1098/rstl.1851.0020, JSTOR:108406.
- ↑ John Stenhouse: On the Action of Nitric Acid on Various Vegetables, with a More Particular Examination of Spartium scoparium, Linn., or Common Broom. Abstract. In: Royal Society (Hrsg.): Abstracts of the Papers Communicated to the Royal Society of London. 1850 - 1854. Band 6. Taylor and Francis, London 1854, S. 3–6, JSTOR:111121 (online im Internet Archive [abgerufen am 2. Februar 2016]).
- ↑ a b John Stenhouse: Ueber die Wirkung von Salpetersäure auf verschiedene Vegetabilien, nebst einer näheren Untersuchung von Spartium Scoparium. Linn. In: Friedrich Wöhler, Justus Liebig, Hermann Kopp (Hrsg.): Annalen der Chemie und Pharmacie. Band 78, Nr. 1. C.F. Winter, Heidelberg 1851, S. 1–30 (online beim Internet Archive [abgerufen am 2. Februar 2016]).
- ↑ a b Peter W. Thies: Spartium und Spartein. Vom Besenginster zum Antiarrhythmicum. In: Pharmazie in unserer Zeit. Band 15, Nr. 6. VCH, Weinheim November 1986, S. 172–176, doi:10.1002/pauz.19860150604.
- ↑ Burritt W. Newton, Ralph C. Benson, Colin C. McCorriston: Sparteine sulfate: a potent, capricious oxytocic. In: American Journal of Obstetrics and Gynecology. Band 94, Nr. 2, 15. Januar 1966, S. 234–241.
- ↑ Nelson J. Leonard, Roger E. Beyler: The Total Synthesis of Sparteine. In: ACS (Hrsg.): Journal of the American Chemical Society. JACS. Band 70, Nr. 6, Juni 1948, S. 2298–2299, doi:10.1021/ja01186a522.
- ↑ Nelson J. Leonard, Roger E. Beyler: The Total Synthesis of Sparteine and an Isosparteine by Reductive Cyclization. In: ACS (Hrsg.): Journal of the American Chemical Society. JACS. Band 72, Nr. 3, März 1950, S. 1316–1323, doi:10.1021/ja01159a067.
- ↑ Raissa M. Trend: Sparteine – A lupin alkaloid ( vom 4. April 2015 im Internet Archive) (engl., mit einer Übersicht über die Synthesen)
- ↑ Brenton T. Smith, John A. Wendt, Jeffrey Aubé: First Asymmetric Total Synthesis of (+)-Sparteine. Letter. In: ACS (Hrsg.): Organic Letters. Band 4, Nr. 15, Juli 2002, S. 2577–2579, doi:10.1021/ol026230v.
- ↑ Perivar zur kausalen Behandlung des varikösen Symptomenkomplexes. In: Münchener Medizinische Wochenschrift. Band 95, Nr. 1, 2. Januar 1953, S. LVI.
- ↑ Biochemisches Handlexikon: V. Band: Alkaloide, Tierische Gifte, Produkte der inneren Sekretion, Antigene, Fermente. Herausgegeben von H. Altenburg et al., Seiten 114–117 eingeschränkte Vorschau in der Google-Buchsuche
- ↑ Hans Günther Boit: Ergebnisse de Alkaloid-Chemie bis 1960, unter besonderer Berücksichtigung der Fortschritte seit 1950. Akademie-Verlag, 1961, S. 194.
- ↑ Externe Identifikatoren von bzw. Datenbank-Links zu (+)-Spartein: CAS-Nr.: 492-08-0, EG-Nr.: 805-899-0, ECHA-InfoCard: 100.232.882, PubChem: 7014, ChemSpider: 10254876, Wikidata: Q66604441.
- ↑ Gerhard Richter: Stoffwechselphysiologie der Pflanzen: Physiologie und Biochemie des Primär- und Sekundärstoffwechsels. Georg Thieme Verlag, 1998 eingeschränkte Vorschau in der Google-Buchsuche.
- ↑ Beschreibung der Anwendung bzw. deren Einschränkungen bei arznei-telegramm.de
- ↑ Klinische Pharmakologie: Arzneitherapie, herausgegeben von N. Rietbrock, A.H. Staib, D. Loew, Seite 66, rechte Spalte eingeschränkte Vorschau in der Google-Buchsuche
- ↑ Klinische Pharmakologie: Arzneitherapie, herausgegeben von N. Rietbrock, A.H. Staib, D. Loew, Seite 68 eingeschränkte Vorschau in der Google-Buchsuche
- ↑ S.V. Otton, T. Inaba, W. Kalow: Competitive Inhibition Of Sparteine Oxidation In Human Liver By β-Adrenoceptor Antagonists And Other Cardiovascular Drugs. In: Life Sciences. Band 34, Nr. 1, Januar 1984, S. 73–80, doi:10.1016/0024-3205(84)90332-1.
- ↑ Dieter Hoppe, Thomas Hense: Enantioselektive Synthese mit Lithium/(−)-Spartein-Carbanion-Paaren. In: Angewandte Chemie. Band 109, Nr. 21, 1. Februar 2006, S. 2376–2410, doi:10.1002/ange.19971092105.
- ↑ E. Teuscher: Biogene Arzneimittel. 5. Auflage. Wissenschaftliche Verlagsgesellschaft, 1997. ISBN 3-8047-1482-X. S. 356.