Tetracyanoethylen
Tetracyanoethylen – auch abgekürzt TCNE (TetraCyaNoEthylen) – ist eine hygroskopische organische Verbindung aus der Stoffgruppe der Nitrile und hat eine flache, ebene Struktur.
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
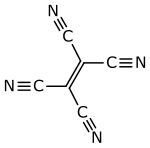
| ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Tetracyanoethylen | |||||||||||||||
| Andere Namen |
| |||||||||||||||
| Summenformel | C6N4 | |||||||||||||||
| Kurzbeschreibung |
rein: farblos, handelsüblich: beige bis gelbliche Masse[1][2] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 128,09 g·mol−1 | |||||||||||||||
| Aggregatzustand |
fest | |||||||||||||||
| Dichte |
1,35 g·cm−3[2] | |||||||||||||||
| Schmelzpunkt | ||||||||||||||||
| Siedepunkt |
223 °C[2] | |||||||||||||||
| Löslichkeit |
| |||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Toxikologische Daten | ||||||||||||||||
| Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | ||||||||||||||||
Darstellung und Reaktionen
BearbeitenTetracyanoethylen wird durch Bromierung von Malonsäuredinitril in Gegenwart von Kaliumbromid hergestellt, wobei ein Kaliumbromid-Komplex erhalten wird, der anschließend mit Kupferpulver in der Hitze dehalogeniert wird.[5][1]
Oxidation von Tetracyanoethylen mit Wasserstoffperoxid führt zum Tetracyanoethylenoxid, welches für ein Epoxid ungewöhnliche chemische Eigenschaften aufweist.[3]
Eigenschaften
BearbeitenTetracyanoethylen sublimiert bei 130–140 °C und 0,133 hPa.[1] TCNE besitzt eine monokline Kristallstruktur mit der Raumgruppe P21/n (Raumgruppen-Nr. 14, Stellung 2) mit einer Einheitszelle mit a = 7,4890 Å, b = 6,2045 Å, c = 69911 Å und β = 97,235°.[6]
TCNE wird oft als Elektronenakzeptor eingesetzt.[6] Cyanogruppen weisen *-Orbitale mit niedriger Energie auf, und die Gegenwart von vier solchen Gruppen, deren -Systeme durch die zentrale C=C-Doppelbindung verbunden (konjugiert) sind, ergibt einen hervorragenden Elektronenakzeptor. So reagiert TCNE mit Iodiden unter Bildung des Radikalanions.[7]
Verwendung
BearbeitenWegen der Planarität des Moleküls und seiner Fähigkeit, leicht Elektronen aufzunehmen, ist TCNE auch verwendet worden, eine Reihe organischer Supraleiter herzustellen – üblicherweise als ein-Elektron-Oxidationsmittel für einen organischen Elektrondonator.[8][9] Solche Charge-Transfer-Komplexe werden (nach Klaus Bechgaard) manchmal Bechgaard-Salze genannt.
Sicherheit
BearbeitenTCNE hydrolysiert in Wasser und an feuchter Luft zu sehr giftiger Blausäure. Entsprechende Vorsichtsmaßnahmen sollten beim Umgang mit der Substanz eingehalten werden.[1]
Einzelnachweise
Bearbeiten- ↑ a b c d e R. A. Carboni: Tetracyanoethylene In: Organic Syntheses. 39, 1959, S. 64, doi:10.15227/orgsyn.039.0064; Coll. Vol. 4, 1963, S. 877 (PDF).
- ↑ a b c d e Datenblatt Tetracyanoethylen bei Merck, abgerufen am 24. April 2011.
- ↑ a b W. J. Linn: Tetracyanoethylene Oxide In: Organic Syntheses. 49, 1969, S. 103, doi:10.15227/orgsyn.049.0103; Coll. Vol. 5, 1973, S. 1007 (PDF).
- ↑ a b Datenblatt Tetracyanoethylene bei Sigma-Aldrich, abgerufen am 3. November 2016 (PDF).
- ↑ The Merck Index. An Encyclopaedia of Chemicals, Drugs and Biologicals, 14. Auflage, 2006, ISBN 978-0-911910-00-1, S. 1582.
- ↑ a b Maria J. Capitán, Jesús Álvarez, Cristina Navio: Study of the electronic structure of electron accepting cyano-films: TCNQversusTCNE. In: Physical Chemistry Chemical Physics. Band 20, Nr. 15, 2018, S. 10450–10459, doi:10.1039/C7CP07963J.
- ↑ Neil G. Connelly, William E. Geiger: Chemical Redox Agents for Organometallic Chemistry. In: Chemical Reviews. Band 96, Nr. 2, 1996, S. 877–910, doi:10.1021/cr940053x.
- ↑ Stuart Cantrill: A noble cause. In: Nature Nanotechnology. 2008, S. 1–1, doi:10.1038/nnano.2008.8.
- ↑ Sailesh Chittipeddi, K. R. Cromack, Joel S. Miller, A. J. Epstein: Ferromagnetism in molecular decamethylferrocenium tetracyanoethenide (DMeFc TCNE). In: Physical Review Letters. Band 58, Nr. 25, 1987, S. 2695–2698, doi:10.1103/PhysRevLett.58.2695.
