Thorpe-Ingold-Effekt
Als Thorpe-Ingold-Effekt (auch gem-dimethyl Effekt oder angle compression Effekt) bezeichnet man in der Organischen Chemie die Auswirkung geminaler Substituenten auf Ringschlussreaktionen.[1][2] Durch geminale Substituenten wie zum Beispiel Methylgruppen wird die Anzahl möglicher Konformationen eingeschränkt und der Bindungswinkel wird verkleinert, wodurch die Substituenten für den Ringschluss einander näher kommen. Der Thorpe-Ingold-Effekt äußert sich sowohl in der Kinetik als auch in der Thermodynamik von Ringschlussreaktionen, da sowohl die Geschwindigkeit des Ringschlusses als auch die Gleichgewichtslage der Ringschlussreaktion beeinflusst wird.[3][4] Bei größeren Ringen geht im Übergangszustand Entropie verloren, durch Verlust von Freiheitsgraden. Das Vorhandensein von Substituenten führt dazu, dass ein Molekül weniger Konformationen einnehmen kann, was wiederum zu einer niedrigeren Entropie der Ausgangsverbindung führt. Die Konformationen, die ein Molekül infolgedessen einnehmen kann, ähneln sich dem Übergangszustand. Entsprechend ist die relative Entropieänderung einer substituierten Verbindung weniger negativ als bei einem unsubstituierten Molekül, weshalb die Gibbs-Energie der Reaktion einer substituierten Verbindung abgesenkt wird. Je negativer die Gibbs-Energie einer Ringschlussreaktion ist, desto bereitwilliger läuft die Ringbildung ab.[3]

Der Effekt ist nach den Chemikern Christopher Kelk Ingold und Jocelyn Field Thorpe benannt, die 1915 darüber berichteten.[5]
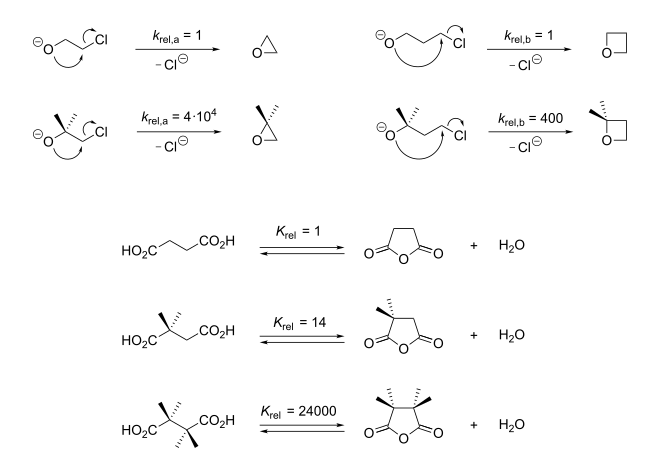
Auswirkung des Thorpe-Ingold-Effektes auf die Kinetik (oben) und Thermodynamik (unten) von Ringschlussreaktionen. Oben: Die Geschwindigkeit des Ringschlusses wird durch geminale Methylsubstituenten beschleunigt. Unten: Die Gleichgewichtslage der Ringschlussreaktion wird durch geminale Substituenten zur Produktseite hin verschoben. Man beachte, dass oben Geschwindigkeitskonstanten unten Gleichgewichtskonstanten angegeben sind.
Siehe auch
BearbeitenEinzelnachweise
Bearbeiten- ↑ Pierre Vogel, Kendall N. Houk, Robert H. Grubbs: Organic Chemistry. 1. Auflage. Wiley-VCH, ISBN 978-3-527-34532-8, S. 198.
- ↑ Michael E. Jung, Grazia Piizzi: gem -Disubstituent Effect: Theoretical Basis and Synthetic Applications. In: Chemical Reviews. Band 105, Nr. 5, 1. Mai 2005, ISSN 0009-2665, S. 1735–1766, doi:10.1021/cr940337h (acs.org [abgerufen am 18. Oktober 2022]).
- ↑ a b Jonathan Clayden, Nick Greeves, Stuart Warren: Organische Chemie. 2. Auflage. Springer Spektrum, 2013, ISBN 978-3-642-34715-3, S. 886 ff.
- ↑ Ronald Brown, Norman Van Gulick: Notes - The Geminal Alkyl Effect on the Rates of Ring Closure of Bromobutylamines. In: The Journal of Organic Chemistry. Band 21, Nr. 9, September 1956, ISSN 0022-3263, S. 1046–1049, doi:10.1021/jo01115a616.
- ↑ Richard Moore Beesley, Christopher Kelk Ingold, Jocelyn Field Thorpe: CXIX.—The formation and stability of spiro-compounds. Part I. spiro-Compounds from cyclohexane. In: Journal of the Chemical Society, Transactions. J. Chem. Soc., Trans., 1915,107, 1080-1106, 1905, doi:10.1039/CT9150701080.
