Titan(III)-phosphid
Titan(III)-phosphid ist eine anorganische chemische Verbindung aus der Gruppe der Phosphide.
| Kristallstruktur | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
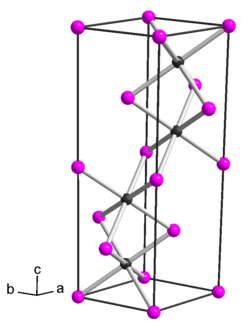
| ||||||||||||||||
| _ Ti3+ _ P3− | ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Titan(III)-phosphid | |||||||||||||||
| Andere Namen |
Titanmonophosphid | |||||||||||||||
| Verhältnisformel | TiP | |||||||||||||||
| Kurzbeschreibung |
schwarzgrauer Feststoff[1] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 78,84 g·mol−1 | |||||||||||||||
| Aggregatzustand |
fest[1] | |||||||||||||||
| Dichte |
3,94 g·cm−3[1] | |||||||||||||||
| Schmelzpunkt | ||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | ||||||||||||||||
Gewinnung und Darstellung
BearbeitenTitan(III)-phosphid kann durch Drucksynthese aus den Elementen gewonnen werden.[1]
Man kann es auch bei der Umsetzung von Monophosphan mit Titan(IV)-chlorid bei 750 °C gewinnen. Ebenfalls möglich ist die elektrolytische Darstellung eines nahezu stöchiometrisch zusammengesetztes Titan(III)-phosphid-Pulvers bei 860 °C aus einer Lösung von 10 % Titandioxid in einer Mischschmelze die neben Di- und Metaphosphat noch Natriumchlorid und Lithiumfluorid enthält.[1]
Fein gepulvertes Titanhydrid kann bei 800-1000 °C mit einer Monophosphan/Wasserstoff-Mischung zu Phosphiden mit kleineren Phosphor-Gehalten umgesetzt werden (TiP0,1-0,6).[1]
Eigenschaften
BearbeitenTitan(III)-phosphid ist ein schwarzgraues, metallisch aussehendes und thermisch sehr beständiges Pulver, das durch Säuren selbst bei Erwärmung wenig angreifbar ist. Es besitzt eine hexagonale Kristallstruktur mit der Raumgruppe P63/mmc (Raumgruppen-Nr. 194) (a = 3,487 Å, c = 11,65 Å).[1]
Verwendung
BearbeitenTitan(III)-phosphid wird als Katalysator in organischen Synthesen verwendet.[3]
Einzelnachweise
Bearbeiten- ↑ a b c d e f g h Georg Brauer (Hrsg.), unter Mitarbeit von Marianne Baudler u. a.: Handbuch der Präparativen Anorganischen Chemie. 3., umgearbeitete Auflage. Band II, Ferdinand Enke, Stuttgart 1978, ISBN 3-432-87813-3, S. 1383.
- ↑ Dieser Stoff wurde in Bezug auf seine Gefährlichkeit entweder noch nicht eingestuft oder eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- ↑ Dale L. Perry: Handbook of Inorganic Compounds, Second Edition. Taylor & Francis US, 2011, ISBN 1-4398-1462-7, S. 488 (eingeschränkte Vorschau in der Google-Buchsuche).