Titandisilicid
Titandisilicid ist eine anorganische chemische Verbindung des Titans aus der Gruppe der Silicide.
| Kristallstruktur | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
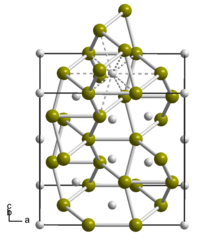
| ||||||||||||||||
| _ Ti _ Si | ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Titandisilicid | |||||||||||||||
| Andere Namen |
Titansilicid (mehrdeutig) | |||||||||||||||
| Verhältnisformel | TiSi2 | |||||||||||||||
| Kurzbeschreibung | ||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 104,07 g·mol−1 | |||||||||||||||
| Aggregatzustand |
fest[2] | |||||||||||||||
| Dichte |
4,02 g·cm−3[1] | |||||||||||||||
| Schmelzpunkt | ||||||||||||||||
| Löslichkeit | ||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | ||||||||||||||||
Gewinnung und Darstellung
BearbeitenTitandisilicid kann durch Reaktion von Titan oder Titanhydrid mit Silicium gewonnen werden.[1]
Ebenfalls möglich ist die Darstellung auf aluminothermischem Wege durch Entzünden eines Gemisches von z. B. Aluminiumpulver, Schwefel, Siliciumdioxid und Titandioxid oder Kaliumfluortitanat K2TiF6, durch Elektrolyse einer Schmelze Kaliumfluortitanat und Titandioxid oder durch Umsetzung von Titan mit Siliciumtetrachlorid.[1]
Es kann auch durch Umsetzung von Titan(IV)-chlorid mit Monosilan, Dichlorsilan oder Silicium gewonnen werden.[3]
Eigenschaften
BearbeitenTitandisilicid ist ein metallisch glänzender, weißgrauer bis schwarzer[2] kristalliner Feststoff mit guter thermischer und elektrischer Leitfähigkeit. Er besitzt orthorhombische Kristallstruktur mit der Raumgruppe Fddd (Raumgruppen-Nr. 70) (a = 825,3 pm, b = 478,3 pm, c = 854,0 pm). Er ist unlöslich in Wasser[2] und Mineralsäuren mit Ausnahme von Flusssäure sowie langsam löslich in 10%iger Kaliumhydroxid-Lösung. Zu beachten ist, das neben Titandisilicid weitere Titansilicide bekannt sind. So TiSi1,8 mit der Raumgruppe Cmcm (Nr. 63) und einer Dichte von 3,9 g·cm−3, Ti3Si mit tetragonaler Kristallstruktur isotyp zu der von Ti3P, Ti5Si4 mit einer Schmelztemperatur von 2120 °C und einer tetragonalen Kristallstruktur isotyp zu der von Zr5Si4 sowie Titanmonosilicid TiSi mit einem Schmelzpunkt von 1760 °C und einer orthorhombischen Kristallstruktur, isotyp zu der von Eisenborid FeB.[1] Es ist weiterhin eine Ti5Si3 Verbindung bekannt.[4][5]
Verwendung
BearbeitenTitandisilicid wird in der Halbleiterindustrie (z. B. im Salicide-Prozess) verwendet.[5] Es kann zur Spaltung von Wasser mit Hilfe von Sonnenlicht eingesetzt werden.[6][7]
Einzelnachweise
Bearbeiten- ↑ a b c d e f Georg Brauer (Hrsg.): Handbuch der Präparativen Anorganischen Chemie. 3., umgearb. Auflage. Band II. Enke, Stuttgart 1978, ISBN 3-432-87813-3, S. 1389.
- ↑ a b c d e f g h Datenblatt Titanium silicide, 99.5% (metals basis) bei Alfa Aesar, abgerufen am 15. Juni 2013 (Seite nicht mehr abrufbar).
- ↑ Hugh O. Pierson: Handbook of Chemical Vapor Deposition, 2nd Edition: Principles, Technology ... William Andrew, 1999, ISBN 0-8155-1743-2, S. 331 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ Datenblatt Titanium silicide Ti5Si3, 99.5% (metals basis) bei Alfa Aesar, abgerufen am 15. Juni 2013 (Seite nicht mehr abrufbar).
- ↑ a b Lih J. Chen: Silicide Technology for Integrated Circuits (Processing). IET, 2004, ISBN 0-86341-352-8, S. 49 ff. (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ pro-physik.de: Wasserspaltung mit Sonnenlicht ( vom 16. März 2013 im Internet Archive), 26. September 2007.
- ↑ Peter Ritterskamp, Andriy Kuklya, Marc-Andre Wüstkamp, Klaus Kerpen, Claudia Weidenthaler, Martin Demuth: Ein auf Titandisilicid basierender, halbleitender Katalysator zur Wasserspaltung mit Sonnenlicht - reversible Speicherung von Sauerstoff und Wasserstoff. In: Angewandte Chemie. 119, 2007, S. 7917–7921, doi:10.1002/ange.200701626.

