Traumatinsäure
Traumatinsäure ist eine natürlich vorkommende, ungesättigte Dicarbonsäure.
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
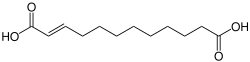
| ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Traumatinsäure | |||||||||||||||
| Andere Namen |
| |||||||||||||||
| Summenformel | C12H20O4 | |||||||||||||||
| Kurzbeschreibung | ||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 228,29 g·mol−1 | |||||||||||||||
| Aggregatzustand |
fest[1] | |||||||||||||||
| Schmelzpunkt | ||||||||||||||||
| Siedepunkt |
150–160 °C (0,133 Pa)[1] | |||||||||||||||
| Löslichkeit |
| |||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | ||||||||||||||||
Geschichte
BearbeitenTraumatinsäure wurde 1939 in der Gartenbohne entdeckt und ihre Rolle als Verletzungshormon in Pflanzen erkannt. Im selben Jahr wurde auch die Struktur aufgeklärt.[4]
Vorkommen
BearbeitenTraumatinsäure ist ein wichtiges Pflanzenhormon aus der Gruppe der Zytokinine.[5] Sie wird vor allem bei Verletzungen gebildet und spielt eine wichtige Rolle bei der Wundheilung der Pflanzen.[6] Neuere Forschungsergebnisse haben aber gezeigt, dass sie auch in Reaktion auf andere Stressfaktoren gebildet wird, darunter extreme Temperaturen, die Einwirkung von UV-Strahlung, oder erhöhte Salzkonzentrationen.[6][7] Traumatinsäure fördert auch die Bildung von Adventivknospen in Pflanzen.[8] Außer in Pflanzen kommt die Traumatinsäure auch in Algen und Pilzen vor.[7]
Der Wirkung des Hormons in Chlorella vulgaris wurde detailliert untersucht, dabei wurde festgestellt, dass das Hormon zu beschleunigter Zellteilung führt, zur verstärkten Bildung diverser Metaboliten wie Monosaccharide und Chlorophyll, sowie zur verstärkten Bildung antioxidativer Enzyme.[6] Ähnliche Ergebnisse ergaben sich auch bei einer analogen Untersuchung an Wurzellosen Zwergwasserlinsen.[9]
Biosynthese
BearbeitenDie biosynthetischen Vorläufer der Traumatinsäure sind Linolsäure und Linolensäure.[6] Die werden durch eine Lipoxygenase zu den entsprechenden 13-Hydroperoxiden umgesetzt. Diese werden in C6- und C12-Einheiten gespalten. Die dabei anfallende 12-Oxo-(9Z)-dodecansäure wird zu 12-Oxo-(10E)-dodecansäure (Traumatin) isomerisiert. Durch nicht-enzymatische Autoxidation entsteht die die Traumatinsäure.[10]
Eigenschaften
BearbeitenIn einer Studie zeigte Traumatinsäure Cytotoxizität gegen Brustkrebs-Zellen.[5]
Verwendung
BearbeitenTraumatinsäure ist in dem Dentalmedikament Restomyl enthalten[11] und eignet sich als Edukt für die Synthese von Prostaglandinen.[12] Sie eignet sich möglicherweise als Biomarker für Sarkopenie.[13]
Einzelnachweise
Bearbeiten- ↑ a b c d e f Eintrag zu Traumatinsäure. In: Römpp Online. Georg Thieme Verlag, abgerufen am 17. August 2023.
- ↑ a b c Eintrag zu Traumatic Acid, >90.0% bei TCI Europe, abgerufen am 18. August 2023.
- ↑ a b c H. M. Rauen: Biochemisches Taschenbuch. Zweite Auflage, Erster Teil, Springer, 1964, ISBN 978-3-642-85768-3, S. 240.
- ↑ James English, James Bonner, A. J. Haagen-Smit: Structure and Synthesis of a Plant Wound Hormone. In: Science. Band 90, Nr. 2336, 6. Oktober 1939, S. 329–329, doi:10.1126/science.90.2336.329.a.
- ↑ a b Agata Jabłońska-Trypuć, Rafał Krętowski, Elżbieta Wołejko, Urszula Wydro, Andrzej Butarewicz: Traumatic acid toxicity mechanisms in human breast cancer MCF-7 cells. In: Regulatory Toxicology and Pharmacology. Band 106, August 2019, S. 137–146, doi:10.1016/j.yrtph.2019.04.023.
- ↑ a b c d Anna Pietryczuk, Romuald Czerpak: Effect of traumatic acid on antioxidant activity in Chlorella vulgaris (Chlorophyceae). In: Plant Growth Regulation. Band 65, Nr. 2, November 2011, S. 279–286, doi:10.1007/s10725-011-9599-5.
- ↑ a b Anna Pietryczuk, Iwona Biziewska, Monika Imierska, Romuald Czerpak: Influence of traumatic acid on growth and metabolism of Chlorella vulgaris under conditions of salt stress. In: Plant Growth Regulation. Band 73, Nr. 2, Juni 2014, S. 103–110, doi:10.1007/s10725-013-9872-x.
- ↑ Shizufumi Tanimoto, Hiroshi Harada: Stimulation of adventitious bud Initiation by cyclic AMP and traumatic acid inTorenia stem segments. In: Biologia Plantarum. Band 26, Nr. 5, September 1984, S. 337–341, doi:10.1007/BF02898568.
- ↑ Anna Pietryczuk, Romuald Czerpak: The effect of traumatic acid on the growth, metabolite content and antioxidant activity in Wolffia arrhiza (L.) Wimm. (Lemnaceae). In: Oceanological and Hydrobiological Studies. Band 41, Nr. 1, 1. März 2012, S. 24–34, doi:10.2478/s13545-012-0003-5.
- ↑ Agata Jabłońska-Trypuć, Walentyn Pankiewicz, Romuald Czerpak: Traumatic Acid Reduces Oxidative Stress and Enhances Collagen Biosynthesis in Cultured Human Skin Fibroblasts. In: Lipids. Band 51, Nr. 9, September 2016, S. 1021–1035, doi:10.1007/s11745-016-4174-5, PMID 27423205, PMC 5009161 (freier Volltext).
- ↑ Tatyana Savchenko, Evgeny Degtyaryov, Yaroslav Radzyukevich, Vlada Buryak: Therapeutic Potential of Plant Oxylipins. In: International Journal of Molecular Sciences. Band 23, Nr. 23, 23. November 2022, S. 14627, doi:10.3390/ijms232314627, PMID 36498955, PMC 9741157 (freier Volltext).
- ↑ James M. Reuter, Robert G. Salomon: Aleuritic acid, an abundant source of prostanoid synthons. In: The Journal of Organic Chemistry. Band 43, Nr. 21, Oktober 1978, S. 4247–4248, doi:10.1021/jo00415a060.
- ↑ Jaw‐Shiun Tsai, San‐Yuan Wang, Chin‐Hao Chang, Chin‐Ying Chen, Chiung‐Jung Wen, Guan‐Yuan Chen, Ching‐Hua Kuo, Y. Jane Tseng, Ching‐Yu Chen: Identification of traumatic acid as a potential plasma biomarker for sarcopenia using a metabolomics‐based approach. In: Journal of Cachexia, Sarcopenia and Muscle. Band 13, Nr. 1, Februar 2022, S. 276–286, doi:10.1002/jcsm.12895, PMID 34939349, PMC 8818620 (freier Volltext).
