Trimethylsilanol
Trimethylsilanol (TMS) ist eine chemische Verbindung und gehört zu den Silanolen. Es ist ein Derivat von Silan und das Siliciumanalogon von tert-Butanol.
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
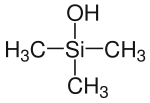
| ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Trimethylsilanol | |||||||||||||||
| Andere Namen |
| |||||||||||||||
| Summenformel | C3H10OSi | |||||||||||||||
| Kurzbeschreibung |
farblose klare Flüssigkeit[1] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 90,20 g·mol−1 | |||||||||||||||
| Aggregatzustand |
flüssig[1] | |||||||||||||||
| Dichte |
0,95 g·cm−3[1] | |||||||||||||||
| Schmelzpunkt | ||||||||||||||||
| Siedepunkt | ||||||||||||||||
| Dampfdruck |
21 mbar (20 °C)[4] | |||||||||||||||
| Löslichkeit |
35–43 g·l−1 in Wasser[5] | |||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | ||||||||||||||||
Darstellung und Gewinnung
BearbeitenEine einfache Hydrolyse des Chlortrimethylsilans führt wegen des Nebenprodukts Salzsäure eher zum Veretherungsprodukt Hexamethyldisiloxan.[7]
Durch eine schwach basisch geführte Hydrolyse ist Trimethylsilanol zugänglich, da so die Dimerisierung vermieden werden kann.[8] Trimethylsilanol kann auch durch die basische Hydrolyse von Hexamethyldisiloxan gewonnen werden.[9]
Eigenschaften
BearbeitenTrimethylsilanol ist eine flüchtige organische Flüssigkeit mit einem Siedepunkt von 98 °C.[3] Die molare Verdampfungsenthalpie beträgt 45,64 kJ·mol−1, die Verdampfungsentropie 123 J·K−1·mol−1.[4] Die Dampfdruckfunktion ergibt sich nach Antoine entsprechend log10(P) = A−(B/(T+C)) (P in bar, T in K) mit A = 5,44591, B = 1767,766 und C = −44,888 im Temperaturbereich von 291 K bis 358 K.[4][10] Unterhalb des Schmelzpunktes bei −4,5 °C[2] erstarrt die Verbindung in einem monoklinen Kristallgitter.[11] Trimethylsilanol ist mit einem pKa-Wert von 11 eine schwache Säure.[12] Die Säurestärke ist vergleichbar mit der der Orthokieselsäure, aber wesentlich höher als bei Alkoholen wie z. B. tert-Butanol (pKa 19[12]).
Verwendung
BearbeitenTMS wird für die hydrophobe Beschichtung bei Silicat-Oberflächen eingesetzt. Es reagiert mit den Silanolgruppen (R3SiOH) des Substrats, wodurch eine Schicht aus Methylgruppen entsteht. TMS tritt üblicherweise als Verunreinigung in Raumschiffen auf, da es aus den Silicon-basierten Materialien ausgast.[13]
Wie andere Silanole wird TMS für den Einsatz als antimikrobieller Wirkstoff untersucht.[14]
TMS ist ein mögliches Hydrolyseprodukt von PDMS-Ketten-Endgruppen.
Siehe auch
BearbeitenEinzelnachweise
Bearbeiten- ↑ a b c Trimethylsilanole. Abgerufen am 7. November 2009.
- ↑ a b Batuew et al. in Doklady Akademii Nauk SSSR 95 (1954) 531.
- ↑ a b Stepovik, L. P.; Kazakina, S. V.; Martynova, I. M. in Russian Journal of General Chemistry – English Version 70 (2000) 1371–1377 oder Zhurnal Obshchei Khimii 70 (2000) 1459–1461.
- ↑ a b c Grubb, W.T.; Osthoff, R.C.: Physical Properties of Organosilicon Compounds. II. Trimethylsilanol and Triethylsilanol in J. Am. Chem. Soc. 75 (1953), 2230–2232; doi:10.1021/ja01105a061.
- ↑ S. M. Mazzoni, S. Roy, S. Grigoras: Eco-Relevant Properties of Selected Organosilicon Materials. In: G. Chandra (Hrsg.): The Handbook of Environmental Chemistry – Organosilicon Materials. Springer-Verlag, Berlin/Heidelberg 1997, ISBN 3-540-62604-2 (Vol. 3, Part H).
- ↑ a b Eintrag zu Trimethylsilanol in der GESTIS-Stoffdatenbank des IFA, abgerufen am 20. Januar 2022. (JavaScript erforderlich)
- ↑ Didier Astruc: Organometallic Chemistry and Catalysis. Springer Science & Business Media, 2007, ISBN 978-3-540-46129-6, S. 331 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ J.A. Cella, J.C. Carpenter: Procedures for the preparation of silanols in J. Organomet. Chem. 480 (1994), 23–23; doi:10.1016/0022-328X(94)87098-5
- ↑ M. Lovric, I. Cepanec, M. Litvic, A. Bartolincic, V. Vinkovic: Croatia Chem. Acta 80 (2007), 109–115.
- ↑ Eintrag zu Silanol, trimethyl- (Phase change data). In: P. J. Linstrom, W. G. Mallard (Hrsg.): NIST Chemistry WebBook, NIST Standard Reference Database Number 69. National Institute of Standards and Technology, Gaithersburg MD, abgerufen am 2. Mai 2013.
- ↑ R. Minkwitz, S. Schneider: Die Tieftemperaturkristallstruktur von Trimethylsilanol. In: Zeitschrift für Naturforschung B. 53, 1998, S. 426–429 (PDF, freier Volltext).
- ↑ a b T. Kagiya, Y. Sumida, T. Tachi: An Infrared Spectroscopic Study of hydrogen Bonding Interaction. Structural Studies of Proton-donating and -accepting Powers in Bull. Chem. Soc. Japan 43 (1970), 3716–3722.
- ↑ Trimethylsilanol, Harold L. Kaplan, Martin E. Coleman, and John T. James Spacecraft Maximum Allowable Concentrations for Selected Airborne Contaminants, Volume 1 (1994).
- ↑ Yun-mi Kim, Samuel Farrah, Ronald H. Baney: Silanol – A novel class of antimicrobial agent. In: Electronic Journal of Biotechnology. 9. Jahrgang, Nr. 2, 2006, S. 176, doi:10.2225/vol9-issue2-fulltext-4 (englisch, ejbiotechnology.info ( des vom 22. November 2010 im Internet Archive) [abgerufen am 7. November 2009]).

