Umbralisib
Umbralisib ist ein Arzneistoff aus der Gruppe der PI3K-Inhibitoren.
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
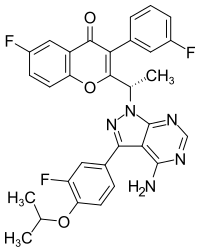
| ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Freiname | Umbralisib | |||||||||||||||
| Andere Namen |
| |||||||||||||||
| Summenformel | C31H24F3N5O3 | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 571,55 g·mol−1 | |||||||||||||||
| pKS-Wert |
2,71[1] | |||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | ||||||||||||||||
Als Ukoniq (TG Therapeutics) wurde es 2021 in den USA zur oralen Behandlung bestimmter Formen des Marginalzonen-Lymphoms und des follikulären Lymphoms zugelassen.[3] Am 1. Juni 2022 wurde die Zulassung von der FDA widerrufen, da eine klinische Studie ein möglicherweise erhöhtes Sterberisiko gezeigt hatte.[4]
Wirkungsmechanismus
BearbeitenUmbralisib hemmt mehrere Kinasen. In vitro wurde die Hemmung der Phosphoinositid-3-Kinase-delta (PIK3δ) und der Caseinkinase-1-epsilon (CK1ε) gezeigt.[1] Sie sind Schlüsselenzyme in Signalwegen des Zellwachstums und Zellstoffwechsels. PI3Kδ wird in normalen und malignen B-Zellen exprimiert, CK1ε ist an der Pathogenese von Krebszellen beteiligt. Umbralisib inhibierte in vitro die Zellproliferation, die CXCL12-vermittelte Zelladhäsion und die CCL19-vermittelte Zellmigration in Lymphomzelllinien.[1]
Anwendung
BearbeitenUmbralisib war in den USA zugelassen für die folgenden Anwendungsgebiete:
- rezidivierendes oder refraktäres Marginalzonen-Lymphom (MZL) bei erwachsenen Patienten, die mindestens ein vorheriges anti-CD20-basiertes Therapieschema erhalten haben;
- rezidivierendes oder refraktäres follikuläres Lymphom (FL) bei erwachsenen Patienten, die zuvor bereits mindestens drei systemische Therapielinien erhalten haben.
Nebenwirkungen und Anwendungsbeschränkungen
BearbeitenAls häufigste Nebenwirkungen wurden Darmbeschwerden mit Durchfall, Erbrechen, Bauchschmerzen, Übelkeit, verminderter Appetit, Müdigkeit, muskuloskelettale Schmerzen, Anämie, Thrombozytopenie, Neutropenie, Infektion der oberen Atemwege und Hautausschlag beobachtet.
Ferner waren die Serumspiegel für Kreatinin und Transaminasen erhöht.
Studien
BearbeitenDie Zulassung erfolgte auf der Grundlage von zwei einarmigen Kohorten einer offenen, multizentrischen Multi-Kohortenstudie an 69 Patienten mit MZL, die mindestens eine vorherige Therapie hatten, einschließlich einer anti-CD20-haltigen Therapie, und an 117 Patienten mit FL nach mindestens zwei vorangegangenen systemischen Therapien. Die Patienten erhielten Umbralisib oral einmal täglich bis zum Fortschreiten der Erkrankung oder bis eine inakzeptable Toxizität auftrat.
Die Wirksamkeit wurde beurteilt nach der Gesamtansprechrate (overall response rate, ORR) und der Dauer der Ansprechzeit (duration of response, DOR) unter Verwendung modifizierter Kriterien der Internationalen Arbeitsgruppe 2007, die von einem unabhängigen Überprüfungsausschuss bewertet wurden.[3]
Sonstiges
BearbeitenUmbralisib ist nach Idelalisib, Copanlisib, Duvelisib und Alpelisib ein weiterer Vertreter der PI3K-Inhibitoren. Allgemein zählen Kinase-Inhibitoren zu den wirksamsten Arzneimitteln in der zielgerichteten Krebstherapie.[5]
Pharmazeutisch wurde der Wirkstoff als Salz der p-Toluolsulfonsäure, Umbralisibtosilat,[6] eingesetzt. Umbralisibtosilat ist ein weißes bis hellbraunes Pulver, das in Dimethylsulfoxid leicht löslich, in Methanol löslich und in Wasser praktisch unlöslich ist. Der pKs-Wert beträgt 2,71.[1]
Einzelnachweise
Bearbeiten- ↑ a b c d Ukoniq Prescribing Information, FDA, 5. Februar 2021.
- ↑ a b Biomol.de: TGR-1202 | CAS 1532533-67-7 | Cayman Chemical | Biomol.de, abgerufen am 3. April 2021
- ↑ a b FDA grants accelerated approval to umbralisib for marginal zone lymphoma and follicular lymphoma, FDA,
- ↑ Center for Drug Evaluation and Research: FDA approval of lymphoma medicine Ukoniq (umbralisib) is withdrawn due to safety concerns. In: FDA. 7. Juni 2022 (fda.gov [abgerufen am 10. April 2023]).
- ↑ S. Klaeger et al.: The target landscape of clinical kinase drugs. In: Science. 2017, doi:10.1126/science.aan4368.
- ↑ Externe Identifikatoren von bzw. Datenbank-Links zu Umbralisibtosilat: CAS-Nr.: 1532533-72-4, PubChem: 86707828, ChemSpider: 58790036, Wikidata: Q106269240.