Uranylfluorid
Uranylfluorid (UO2F2) ist eine Uranverbindung, die ein Zwischenprodukt bei der Umwandlung von Uranhexafluorid UF6 in ein Uranoxid oder in die metallische Form des Urans ist, es entsteht ferner bei der Reaktion von UF6 mit Luftfeuchtigkeit.
| Kristallstruktur | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
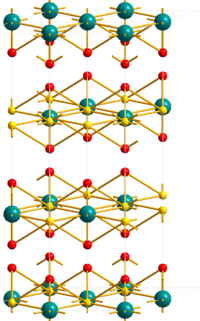
| ||||||||||||||||
| _ U6+ _ O2− _ F− | ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Uranylfluorid | |||||||||||||||
| Verhältnisformel | UO2F2 | |||||||||||||||
| Kurzbeschreibung | ||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 308,02 g·mol−1 | |||||||||||||||
| Aggregatzustand |
fest | |||||||||||||||
| Schmelzpunkt |
(keiner, zersetzt sich ab 300 °C)[3] | |||||||||||||||
| Löslichkeit |
sehr gut in Wasser (64,4 g/100 g Wasser, 20 °C)[4] | |||||||||||||||
| Gefahren- und Sicherheitshinweise | ||||||||||||||||
 Radioaktiv | ||||||||||||||||
| ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | ||||||||||||||||
Eigenschaften
BearbeitenUranylfluorid ist ein hellgelber, grünlichstichiger Festkörper, dessen Farbintensität etwas variiert.[1][2] Gut kristallines Uranylfluorid ist nur wenig hygroskopisch. Oberhalb von 300 °C zerfällt UO2F2 – je nach Temperatur und Sauerstoffdruck – in HF und UO3 bzw. U3O8.[8]
Toxizität
BearbeitenAkute Toxizität geht hauptsächlich von den Fluoridionen der Verbindung aus (Fluorose). Uranylfluorid ist, wie alle Uranverbindungen, sehr giftig. Seine Radioaktivität spielt bezüglich der Gefährlichkeit eine geringere Rolle, obwohl man gewisse Strahlenschutzvorkehrungen treffen sollte, wenn angereichertes Uran (235U) in der Verbindung vorhanden ist, da Natururan ein Alphastrahler ist. Der Stoff ist ätzend und gefährlich beim Einatmen, beim Verschlucken oder Hautkontakt. Eine Inkorporation durch Inhalation oder Verschlucken kann sich verheerend auf den Organismus auswirken. Die Folgen können mit Verzögerung auftreten.[9]
Literatur
Bearbeiten- Ingmar Grenthe, Janusz Drożdżynński, Takeo Fujino, Edgar C. Buck, Thomas E. Albrecht-Schmitt, Stephen F. Wolf: Uranium, in: Lester R. Morss, Norman M. Edelstein, Jean Fuger (Hrsg.): The Chemistry of the Actinide and Transactinide Elements, Springer, Dordrecht 2006; ISBN 1-4020-3555-1, S. 253–698; doi:10.1007/1-4020-3598-5_5.
- Gmelins Handbuch der anorganischen Chemie, Uran, Ergänzungsband C 8, Springer-Verlag, Berlin, Heidelberg, New York 1980, S. 285.
Einzelnachweise
Bearbeiten- ↑ a b J.J. Katz, E. Rabinowitch: The chemistry of uranium, Pt. 1, McGraw-Hill, New York – Toronto – London 1951, S. 564–577.
- ↑ a b Georg Brauer (Hrsg.), unter Mitarbeit von Marianne Baudler u. a.: Handbuch der Präparativen Anorganischen Chemie. 3., umgearbeitete Auflage. Band II, Ferdinand Enke, Stuttgart 1978, ISBN 3-432-87813-3, S. 1218.
- ↑ W. L. Myers: A literature review on the chemical and physical properties of uranyl fluoride, Appendix A of the PEIS (DOE/EIS-0269) (Los Alamos National Lab)., NM (USA) Illinois Univ. Urbana, IL (USA).
- ↑ David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press / Taylor and Francis, Boca Raton FL, Properties of the Elements and Inorganic Compounds, S. 4-97.
- ↑ Eintrag zu Uranverbindungen in der GESTIS-Stoffdatenbank des IFA, abgerufen am 1. Februar 2016. (JavaScript erforderlich)
- ↑ Nicht explizit in Verordnung (EG) Nr. 1272/2008 (CLP) gelistet, fällt aber mit der angegebenen Kennzeichnung unter den Gruppeneintrag uranium compounds with the exception of those specified elsewhere in this Annex im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 1. Februar 2016. Hersteller bzw. Inverkehrbringer können die harmonisierte Einstufung und Kennzeichnung erweitern.
- ↑ Die von der Radioaktivität ausgehenden Gefahren gehören nicht zu den einzustufenden Eigenschaften nach der GHS-Kennzeichnung.
- ↑ F. Coenen: „The preparation of α-UO3 by the high temperature hydrolysis of uranyl halides“, in: J. Inorg. Nucl. Chem., 1966, 28, S. 1733–1734; doi:10.1016/0022-1902(66)80077-5.
- ↑ Georg Brauer (Hrsg.), unter Mitarbeit von Marianne Baudler u. a.: Handbuch der Präparativen Anorganischen Chemie. 3., umgearbeitete Auflage. Band II, Ferdinand Enke, Stuttgart 1978, ISBN 3-432-87813-3, S. 1185–1189.


