Wasserdampfdestillation
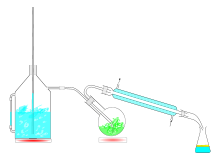
Die Wasserdampfdestillation ist eine Trägerdampfdestillation – ein Trennverfahren, mit dem schwer flüchtige, im Schleppmittel (in diesem Falle Wasser) unlösliche Stoffe getrennt oder gereinigt werden können, z. B. Öle oder Aromaten. Die wasserunlösliche Probe wird dazu zunächst mit heißem Wasser in den Destillationskolben gegeben, anschließend wird Wasserdampf in den Kolben eingeleitet. Die Wasserdampfdestillation ist ein Beispiel für eine azeotrope Destillation, bei der Wasser als Schleppflüssigkeit benutzt wird.[1]
Verfahren
BearbeitenBei einer Trägerdampfdestillation wird eine niedriger siedende Komponente in der Regel in das Lösungsmittel eingeleitet, deren Partialdruck sich zum Partialdruck der höhersiedenden Komponente addiert, sodass das Gemisch eher siedet. Am Siedepunkt der niedrig siedenden Komponente werden die Teilchen der höhersiedenden mitgerissen.[2] Auf diese Weise kann eine Siedepunktserniedrigung herbeigeführt werden. Durch diese Siedepunktserniedrigung können Lösungsmittel schonender destilliert oder empfindliche Substanzen schonender aufkonzentriert werden (siehe auch Vakuumdestillation). Wasserdampf und die leichter flüchtigen Anteile der Probe verdampfen und gelangen gasförmig bis zum Kühler, wo sie zur Flüssigkeit kondensieren. Ist der zu reinigende Stoff nur wenig wasserlöslich, so trennt er sich im Destillat als zweite Phase ab und kann durch Dekantieren und/oder Extraktion abgetrennt werden. Nicht alle wasserunlöslichen Stoffe sind so destillierbar. Stoffe, die so destillierbar sind, bezeichnet man als wasserdampfflüchtig. Die Siedetemperatur des heterogenen Gemischs liegt immer unter 100 °C. Die Ursache hierfür ist, dass der Gesamtdampfdruck nicht ineinander lösbarer Gemische sich aus der Summe der Partialdrücke der Komponenten, unabhängig von ihrem Stoffmengenanteil, ergibt. Dadurch liegt der Gesamtdampfdruck immer über dem Dampfdruck des Wassers, der es bei 1013 mbar bei 100 °C sieden lässt, somit muss die Siedetemperatur immer unter 100 °C liegen. Deshalb lassen sich auch empfindliche Naturstoffe mit sehr geringem Dampfdruck nach dieser Methode destillieren.
Anwendung in der Analytik (Methode nach Kjeldahl)
BearbeitenZur Bestimmung des Stickstoffgehalts wird bei der Analyse nach Kjeldahl der entstehende Ammoniak mit Wasserdampf aus der aufgeschlossenen Probe geschleppt und in eine Säure eingeleitet. Die Säure wird im Überschuss vorgelegt und der Überschuss anschließend durch Rücktitration bestimmt.
Fortlaufende Wasserdampfdestillation
BearbeitenBei der herkömmlichen Wasserdampfdestillation wird eine große Menge Wasserdampf benötigt und das eigentliche Destillat muss erst von diesem Wasser getrennt werden. Verbessern lässt sich das Verfahren durch ein Auffang- und Rückflusssystem: Die zu destillierende Probe, z. B. Pflanzenteile, befindet sich in einem Rundkolben mit destilliertem Wasser. In einem Zweiten befindet sich ein organisches Lösungsmittel, das den gewünschten Stoff löst, z. B. Dichlormethan. Beide Rundkolben sind über ein Glasrohrsystem miteinander verbunden, dessen Form an einen Dreizack erinnert, mit den Rundkolben an der jeweiligen Außenspitze. Das Mittelrohr ist unten verschlossen. Vom unteren Teil des Mittelrohres gibt es ein schmales Rückflussrohr zum Rohr, an das der Rundkolben mit dem Lösungsmittel angeschlossen ist. Dieser Rückfluss endet etwas unterhalb der Höhe des Wasserrohres. Alle drei großen Rohre laufen am oberen Ende zusammen und dort wird ein Liebig-Kühler aufgesetzt. Im Mittelrohr sammelt sich während des Betriebes das Destillat, das in zwei Phasen getrennt ist, in die wässrige und in die organische. Das Lösungsmittel muss eine höhere Dichte haben als Wasser, damit es sich unten sammelt und schließlich über den Rückfluss wieder im Lösungsmittelkolben ankommt.
Nach dem Ende dieser Destillation wird das restliche Destillat aus dem Mittelkolben in den Lösungsmittelkolben gegeben. Dem folgt eine Phasentrennung über einem Scheidetrichter. Anschließend wird die organische Phase über Natriumsulfat oder Magnesiumsulfat getrocknet und filtriert. Das organische Lösungsmittel kann nun eingedampft werden und man erhält das erwünschte Naturstoffgemisch.
Weblinks
Bearbeiten- Praktikumsanweisung zur Dampfdestillation, FU Berlin
Literatur
BearbeitenÜber die kontinuierliche Wasserdampfdestillation:
- D. B. Gujarathi, N. T. Ilay: Continuous Water Circulation Distillation: A Modification of Steam Distillation. In: Journal of Chemical Education. 70, 1993, S. 86, doi:10.1021/ed070p86.
- Chemietechnik, 7. Auflage, Dr.-Ing. Eckhard Ignatiowitz, Europa-Lehrmittel Verlag, 2003.
Einzelnachweise
Bearbeiten- ↑ Walter Wittenberger: Chemische Laboratoriumstechnik, Springer-Verlag, Wien, New York, 7. Auflage, 1973, S. 180–183, ISBN 3-211-81116-8.
- ↑ Michael Wächter: Chemielabor – Einführung in die Laborpraxis, Wiley-VCH Verlag, Weinheim, 1. Auflage, 2011, S. 77–80, ISBN 978-3-527-32996-0.