γ-Valerolacton
γ-Valerolacton (gamma-Valerolacton, GVL, 5-Methyloxolan-2-on) ist das furanoide Lacton der 5-Hydroxy-valeriansäure (5-Hydroxypentansäure). γ-Valerolacton wird als Plattformchemikalie aus nachwachsenden Rohstoffen betrachtet,[5] die zukünftig als Monomer für Polyester, als „grünes“ Lösungsmittel, sowie als biogener Brennstoff und biogener Kraftstoff Verwendung finden könnte.[6]
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
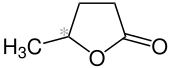
| ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | γ-Valerolacton | |||||||||||||||
| Andere Namen | ||||||||||||||||
| Summenformel | C5H8O2 | |||||||||||||||
| Kurzbeschreibung | ||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 100,12 g·mol−1 | |||||||||||||||
| Aggregatzustand |
flüssig | |||||||||||||||
| Dichte | ||||||||||||||||
| Schmelzpunkt | ||||||||||||||||
| Siedepunkt | ||||||||||||||||
| Dampfdruck | ||||||||||||||||
| Löslichkeit | ||||||||||||||||
| Brechungsindex |
1,4310–1,4340 (20 °C)[4] | |||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Toxikologische Daten | ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). Brechungsindex: Na-D-Linie, 20 °C | ||||||||||||||||
Herstellung
BearbeitenDie intramolekulare Cyclisierung von Allylessigsäure (4-Penten-säure) – aus Allylacetessigester über Allylacetessigsäure zugänglich[7] – mit in situ aus Eisen(III)-chlorid und Silbertrifluormethansulfonat erzeugtem Eisentriflat liefert γ-Valerolacton bei 80 °C in 1,2-Dichlorethan in 93%iger Ausbeute.[8]
1,4-Pentandiol – z. B. durch Hydrierung von α-Angelicalacton an einem Kupferchromit-Kontakt[9] – kann mithilfe eines Katalysatorsystems aus Laccase und 2,2,6,6-Tetramethylpiperidinyloxyl (TEMPO) in 97%iger Ausbeute in γ-Valerolacton überführt werden.[10]
Durch selektive Hydrierung der ringständigen Doppelbindung von α-Angelicalacton – in 90%iger Ausbeute durch Vakuumdestillation von Lävulinsäure[11] herstellbar – mit nanoskaligem Palladium wird γ-Valerolacton in 98%iger Ausbeute erhalten.[12]
Die bei dem säurekatalysierten Abbau von Cellulose mit den Zwischenstufen Hexosen und Hydroxymethylfurfural (neben äquimolekuaren Mengen von Ameisensäure) anfallende Lävulinsäure[13] ist in neuerer Zeit als weiteres Plattformmolekül aus Biomasse zum wichtigsten Ausgangsmaterial für γ-Valerolacton geworden.[6]
Die Hydrierung von Lävulinsäure zu γ-Valerolacton kann mit einer Vielzahl von heterogenen Katalysatoren[14] und Katalysatorsystemen, wie z. B. Nickel[15], Platin(IV)-oxid[16], Gold-Nanopartikeln,[17] Ruthenium/Zinn-Katalysatoren,[18] Ruthenium-Nanopartikeln[19] oder Ruthenium-Palladium-Titandioxid-Nanolegierungen[20] mit sehr guten Umsätzen von Lävulinsäure (>90 %) und exzellenten Selektivitäten für γ-Valerolacton (>99 %) durchgeführt werden.
Die Hydrierung kann mit Wasserstoff
oder durch Umsetzung der bei der Umsetzung von Hydroxymethylfurfural zusammen mit Lävulinsäure in äquimolaren Mengen anfallenden Ameisensäure als Wasserstoffquelle bereits bei relativ niedrigen Temperaturen (100 °C) mit außergewöhnlich hoher Ausbeute (>99 %) und Reinheit (>99,9 %) erfolgen.[21]
Probleme mit den sehr unterschiedlichen Löslichkeiten von Edukten und Produkten können mit der Durchführung der Hydrierung in Zweiphasengemischen begegnet werden.[22]
Während die älteren Arbeiten auf Hexosen und Cellulose als Ausgangsmaterial für Lävulinsäure basierten, steht in jüngster Zeit die Synthese von γ-Valerolacton direkt aus Biomasse, insbesondere aus Biomasse der so genannten 2. Generation, also cellulosischen Abfallprodukten, wie z. B. Maisstängel (engl. corn stover) im Vordergrund.[18][23]
Stereochemie
Bearbeiten| Enantiomere von γ-Valerolacton | |
|---|---|
| (R)-Form |
(S)-Form |
γ-Valerolacton enthält ein Stereozentrum und liegt in Form zweier spiegelbildlich aufgebauter Enantiomere vor. Wenn keine aufwändige stereoselektive Synthesemethode oder Trenntechnik angewandt wurde, liegt ein 1:1-Stoffgemisch (Racemat) von (R)- und (S)-Form vor.
Eine direkte Synthese der (S)-Form ist aus Lävulinsäure mithilfe eines Liganden-modifizierten SEGPHOS-Ruthenium-Katalysators in Methanol als Co-Lösungsmittel möglich.[24]
Eigenschaften
BearbeitenReines γ-Valerolacton ist eine wasserklare, farblose Flüssigkeit mit angenehmem Geruch, der als kräuterartig, süß, warm, tabakartig, kokosartig und holzig beschrieben wird.[25] Der Geschmack von γ-Valerolacton wird als brechreizerregend beschrieben.[26] Es erstarrt bei −31 °C und siedet bei 205–206 °C. Sein Flammpunkt liegt bei 96 °C. Bereits bei Temperaturen über 170 °C beginnt sich γ-Valerolacton zu zersetzen.[16]
Wegen seiner guten Wasserlöslichkeit bereitet die vollständige Abtrennung von GVL aus wässrigen Lösungen, wie sie beim Säureabbau von Hexosen meist vorliegen, erhebliche Schwierigkeiten.
Anwendungen
Bearbeitenγ-Valerolacton wird wegen seiner einfachen und effizienten Zugänglichkeit aus Biomasse, insbesondere aus Cellulose und lignocellulosischen Reststoffen, wie z. B. Holzabfällen und Nahrungspflanzenresten, als „grünes“ Lösungsmittel mit einem sehr breiten Flüssigkeitsbereich von ca. 230 °C, als Monomer für Polyester und als Kraftstoffadditiv bzw. als biogener Kraftstoff (Benzin, Diesel und Kerosin) diskutiert.[6][13][27]
In säurehaltigen Gemischen aus GVL und Wasser kann Biomasse in Form lignocellulosischer Reststoffe vollständig, d. h. einschließlich der Lignin-Fraktion, in Lösung gebracht und einer thermischen Verzuckerung zugeführt werden. Die erhaltenen löslichen Kohlenhydrate können in guter Ausbeute durch Zugabe von Natriumchlorid oder flüssigem Kohlendioxid aus dem Gemisch extrahiert werden.[28]
Wegen seiner niedrigen Ringspannung ist die Neigung zur ringöffnenden Polymerisation bei γ-Valerolacton nur sehr gering ausgeprägt. Mit ε-Caprolacton konnte GVL zu bioabbaubaren Polymeren für biomedizinische Anwendungen, z. B. Implantate copolymerisiert werden.[29]
Nachteilig bei der Verwendung als Treibstoff bzw. als Dieseladditiv ist die sehr niedrige Cetanzahl von γ-Valerolacton von <10 (Diesel >50); vorteilhaft seine Eigenschaft, den Partikelausstoß von Dieselmotoren deutlich zu verringern.[30]
γ-Valerolacton erscheint wegen seines zum Erbrechen reizenden Geschmacks wenig geeignet als legaler Ersatz für die Partydroge γ-Butyrolacton, die im Körper zu der als Betäubungsmittel eingestuften γ-Hydroxybuttersäure (GHB) metabolisiert wird. Auch ist die aus GVL entstehende γ-Hydroxyvaleriansäure wesentlich weniger wirksam als GHB.[26]
Einzelnachweise
Bearbeiten- ↑ Eintrag zu GAMMA-VALEROLACTONE in der CosIng-Datenbank der EU-Kommission, abgerufen am 12. Dezember 2021.
- ↑ a b c d e f g h i j Eintrag zu gamma-Valerolacton in der GESTIS-Stoffdatenbank des IFA, abgerufen am 4. Juli 2015. (JavaScript erforderlich)
- ↑ a b c Datenblatt γ-Valerolacton bei Sigma-Aldrich, abgerufen am 4. Juli 2015 (PDF).
- ↑ a b c d Eintrag zu γ-Valerolacton bei TCI Europe, abgerufen am 4. Juli 2015.
- ↑ K. Yan, Y. Yang, J. Chai, Y. Lu: Catalytic reactions of gamma-valerolactone: A platform to fuels and value-added chemicals. In: Appl. Catal. B: Environmental. Band 179, 2015, S. 292–305, doi:10.1016/j.apcatb.2015.04.030.
- ↑ a b c D.M. Alonso, S.G. Wettstein, J.A. Dumesic: Gamma-valerolactone, a sustainable platform molecule derived from lignocellulosic biomass. In: Green Chem. Band 15, 2013, S. 584–595, doi:10.1039/C3GC37065H.
- ↑ A. Messerschmidt: Untersuchungen über die ungesättigten Säuren. Ueber die Allylessigsäure und das Valerolacton. In: Justus Liebigs Ann. Chem. Band 208, Nr. 1–2, 1881, S. 92–104, doi:10.1002/jlac.18812080107.
- ↑ K. Komeyama, Y. Mieno, S. Yukawa, T. Morimoto, K. Takaki: Cationic iron-catalyzed addition of carboxylic acids to olefins. In: Chem. Lett. Band 36, Nr. 6, 2007, S. 752–753, doi:10.1246/cl.2007.752.
- ↑ J.H. Helberger, S. Ulabay, H. Civelekoglu: Ein einfaches Verfahren zur Gewinnung von α-Angelicalacton und über die hydrierende Spaltung sauerstoffhaltiger Ringe. In: Justus Liebigs Ann. Chem. Band 561, Nr. 3, 1949, S. 215–220, doi:10.1002/jlac.19495610307.
- ↑ A. Díaz-Rodríguez, I. Lavandera, S. Kanbak-Aksu, R.A. Sheldon, V. Gotor, V. Gotor-Fernández: From Diols to Lactones under Aerobic Conditions using a Laccase/TEMPO Catalytic System in Aqueous Medium. In: Adv. Synth. Catal. Band 354, 2012, S. 3405–3408, doi:10.1002/adsc.201200892.
- ↑ Patent US2809203: Method of converting levulinic acid into alpha angelica lactone. Angemeldet am 14. Mai 1953, veröffentlicht am 8. Oktober 1957, Anmelder: Heyden Newport Chemical Co., Erfinder: R.H. Leonard.
- ↑ N. Kim, M.S. Kwon, C.M. Park, J. Park: One pot synthesis of recyclable palladium catalysts for hydrogenations and carbon-carbon coupling reactions. In: Tetrahedron Lett. Band 45, Nr. 38, 2004, S. 7057–7059, doi:10.1016/tetlet.2004.07.126.
- ↑ a b M.J. Climent, A. Corma, S. Iborra: Conversion of biomass platform molecules into fuel additives and liquid hydrocarbon fuel. In: Green Chem. Band 16, 2014, S. 516–547, doi:10.1039/c3gc41492b.
- ↑ W. Wright, R. Palkovits: Development of heterogeneous catalysts for the conversion of levulinic acid into gamma-valerolactone. In: Chemsuschem. Band 5, 2012, S. 1657–1667, doi:10.1002/cssc.201200111.
- ↑ Patent US2368366: Process for the production of lactones. Angemeldet am 21. August 1942, veröffentlicht am 30. Januar 1945, Anmelder: Monsanto Chemical Co., Erfinder: L.P. Kyrides, W. Groves, J.K. Craver.
- ↑ a b H.A. Schuette, R.W. Thomas: Normal valerolactone. III. Its preparation by the catalytic reduction of levulinic acid with hydrogen in the presence of platinum oxide. In: J. Am. Chem. Soc. Band 52, Nr. 7, 1930, S. 3010–3012, doi:10.1021/ja01370a069.
- ↑ X.-L. Du, L. He, S. Zhao, Y.-M. Liu, Y. Cao, H.-Y. He, K.-N. Fan: Hydrogen-independent reductive transformation of carbohydrate biomass into γ-valerolactone and pyrrolidone derivatives with supported gold catalysts. In: Angew. Chem. Band 123, Nr. 34, 2011, S. 7961–7965, doi:10.1002/ange.201100102.
- ↑ a b D.M. Alonso, J.M.R. Gallo, M.A. Mellmer, S.G. Wettstein, J.A. Dumesic: Direct conversion of cellulose to levulinic acid and gamma-valerolactone using solid acid catalysts. In: Catal. Sci. Technol. Band 3, 2013, S. 925–931, doi:10.1039/C2CY20689G.
- ↑ V.S. Java, M. Sudharkar, S.N. Kumar, A. Venugopal: Selective hydrogenation of levulinic acid to γ-valerolactone over a Ru/Mg-LaO catalyst. In: RSC Adv. Band 5, 2015, S. 9044–9049, doi:10.1039/C4RA16557H.
- ↑ W. Luo, M. Sankar, A.M. Beale, Q. He, C.J. Kiely, P.C.A. Bruijnincx, B.M. Weckhuysen: High performing and stable supported nano-alloys for the catalytic hydrogenation of levulinic acid to γ-valerolactone. In: Nature Commun. Band 5, Nr. 6540, 2015, doi:10.1038/ncomms7540.
- ↑ V. Fábros, L.T. Mika, I.T. Horváth: Selective conversion of levulinic and formic acids to γ-valerolactone with the Shvo catalyst. In: Organometallics. Band 33, Nr. 1, 2014, S. 181–187, doi:10.1021/om400938h.
- ↑ S.G. Wettstein, D.M. Alonso, Y. Chong, J.A. Dumesic: Production of levulinic acid and gamma-valerolactone (GVL) from cellulose using GVL as solvent in biphasic systems. In: Energy Environ. Sci. Band 5, 2012, S. 8199–8203, doi:10.1039/C2EE22111J.
- ↑ V. Molinari, M. Antonietti, D. Esposito: An integrated strategy for the conversion of cellulosic biomass into gamma-valerolactone. In: Catal. Sci. Technol. Band 4, Nr. 10, 2014, S. 3626–3630, doi:10.1039/c4cy00717d.
- ↑ József M. Tukacs, Bálint Fridrich, Gábor Dibó, Edit Székely, László T. Mika: Direct asymmetric reduction of levulinic acid to gamma-valerolactone: synthesis of a chiral platform molecule. In: Green Chemistry. 17, 2015, S. 5189, doi:10.1039/C5GC01099C.
- ↑ The Good Scents Company: gamma-valerolactone
- ↑ a b H. Andresen-Streichert, H. Jungen, A. Gehl, A. Müller, S. Iwersen-Bergmann: Uptake of Gamma-Valerolactone—Detection of Gamma-Hydroxyvaleric Acid in Human Urine Samples. In: J. Analyt. Toxicol. Band 37, Nr. 4, 2013, S. 250–254, doi:10.1093/jat/bkt013.
- ↑ I.T. Horváth, H. Mehdi, V. Fábos, L. Boda, L.T. Mika: γ-Valerolactone, a sustainable liquid for energy and carbon-based chemicals. In: Green Chem. Band 10, 2008, S. 238–242, doi:10.1039/B712863K.
- ↑ J.S. Luterbacher, J.M. Rand, D.M. Alonso, J. Han, J.T. Youngquist, C.T. Maravelias, B.F. Pfleger, J.A. Dumesic: Nonenzymatic sugar production from biomass using biomass-derived γ-valerolactone. In: Science. Band 343, Nr. 6168, 2014, S. 277–280, doi:10.1126/science.1246748.
- ↑ M. Gagliardi, F. Di Michele, B. Mazzolai, A. Bifone: Chemical synthesis of a biodegradable PEGylated copolymer from ε-caprolactone and γ-valerolactone: evaluation of reaction and functional properties. In: J. Polym. Res. Band 22:17, 2015, S. 1–12, doi:10.1007/s10965-015-0661-2.
- ↑ Á. Bereczky, K. Lukács, M. Farkas, S. Dóbé: Effect of γ-Valerolactone Blending on Engine Performance, Combustion Characteristics and Exhaust Emissions in a Diesel Engine. In: Natural Resources. Band 5, 2014, S. 177–191, doi:10.4236/nr.2014.55017.
