2-Benzoylbenzoesäure
2-Benzyolbenzoesäure weist neben der Ketongruppe einer Benzophenons die Carbonsäurefunktion einer Benzoesäure auf und ist ein wichtiger Ausgangsstoff für Anthrachinon und seine technisch bedeutendsten Folgeprodukte, die Anthrachinonfarbstoffe.
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
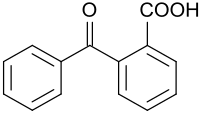
| ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | 2-Benzoylbenzoesäure | |||||||||||||||
| Andere Namen |
| |||||||||||||||
| Summenformel | C14H10O3 | |||||||||||||||
| Kurzbeschreibung | ||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 226,23 g·mol−1 | |||||||||||||||
| Aggregatzustand |
fest | |||||||||||||||
| Dichte | ||||||||||||||||
| Schmelzpunkt | ||||||||||||||||
| Siedepunkt | ||||||||||||||||
| Löslichkeit |
leicht löslich in Ethanol und Diethylether, löslich in heißem Benzol und Wasser[2] | |||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Toxikologische Daten | ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | ||||||||||||||||
Vorkommen und Darstellung
BearbeitenEine detaillierte Synthesevorschrift für o-Benzoylbenzoesäure wurde 1916 von Gustav Heller publiziert.[5]
In einer Friedel-Crafts-Acylierung reagiert Phthalsäureanhydrid mit überschüssigem Benzol in Gegenwart von Aluminiumchlorid zum Aluminiumsalz der 2-Benzoylbenzoesäure, das nach Zersetzung mit Wasser das Reinprodukt in Ausbeuten von 95 bis 97 % liefert. Da sich das Reaktionsgemisch während der Umsetzung verfestigt, wird oft mit großem Benzolüberschuss oder mit inerten Lösungsmitteln gearbeitet, was die Aufarbeitung erschweren und Abwasserprobleme verursachen kann.
Ein neueres Alternativverfahren führt die Reaktion kontinuierlich in einem Knetreaktor mit Natriumchlorid als Verdünnungsmittel in annähernd stöchiometrischem Verhältnis mit kurzen Verweilzeiten, hohen Raum-Zeit-Ausbeuten und geringem Aufarbeitungsaufwand durch.[6]
Der Verlust des Katalysators AlCl3 bei der Hydrolyse und die beschwerliche Aufarbeitung der Reaktionsansätze legen als Alternative die Verwendung des Gemischs Fluorwasserstoff HF und Bortrifluorid BF3 als Friedel-Crafts-Acylierungskatalysator nahe.[7] Unbefriedigende Ausbeuten (66 %), aufwendige Handhabung und Rückgewinnung des problematischen HF-BF3-Gemischs[8] lassen diesen Syntheseweg aber wenig attraktiv erscheinen.
Eigenschaften
Bearbeiten2-Benzoylbenzoesäure ist ein weißes Kristallpulver, das sich in Ethanol und Diethylether leicht löst. Die hochreine Substanz kann durch Umkristallisieren in Cyclohexan oder Auflösen in wenig heißem Toluol, Zugabe von Petrolether bis zur einsetzenden Trübung und Abkühlen erhalten werden.[9]
Anwendungen
BearbeitenVeresterung der o-Benzoylbenzoesäure mit absolutem Methanol und Schwefelsäure liefert o-Benzoylbenzoesäuemethylester,[10] der als radikalischer Photopolymerisationsinitiator Verwendung findet.[11] Wegen der Lichtempfindlichkeit der 2-Benzoylbenzoesäureester eignet sich die Säure auch als photolabile Schutzgruppe für primäre und sekundäre Alkohole, sowie für Thiole.[12]
In Gegenwart primärer Amine als Elektronendonor ED wird bei der Photolyse von 2-Benzoylbenzoesäureestern die Ketongruppe reduziert und anschließend lactonisiert, wobei neben dem freien Alkohol 3-Phenylphthalid gebildet wird.
Der Synthesebaustein 3-Phenylphthalid wird in quantitativer Ausbeute auch durch Reduktion von 2-Benzoylbenzoesäure mit Zink und Eisessig erhalten.[13]
Das nicht-opioide Analgetikum Nefopam ist in einer mehrstufigen Synthese aus 2-Benzoylbenzoesäure zugänglich.[14]
Neuerdings wurde auch eine Eintopfreaktion mit 2-Benzoylbenzoesäure in Toluol mit 79 % Gesamtausbeute und exzellenter Reinheit (99,9 %) an Nefopam berichtet.[15] Aus dem Carbonsäurechlorid der 2-Benzoylbenzoesäure und N-Methylaminoethanol entsteht ein Amid, dessen Ketongruppe zum Alkohol hydriert und anschließend zum 1H-2,5-Benzoxazocin-Ring cyclisiert wird.
Bereits 1874 wurde die Eignung von o-Benzoylbenzoesäure neben dem Steinkohlenteerbestandteil Anthracen als brauchbare Ausgangsverbindung für Anthrachinon erkannt.[16]
Beim Erhitzen mit Phosphorpentoxid auf 200 °C wurde dabei Anthrachinon in 26%iger Ausbeute erhalten.
Im selben Jahr konnte Carl Liebermann zeigen, dass o-Benzoylbenzoesäure bei Erhitzen mit rauchender Schwefelsäure in Anthrachinon übergeht und weiter zur Alizarinvorstufe Anthrachinon-2-sulfonsäure sulfoniert wird.[17]
2-Benzoylbenzoesäure liefert bei einstündigem Erhitzen in konzentrierter Schwefelsäure auf 150 °C Anthrachinon in quantitativer Ausbeute. Auch das bei der Synthese von 2-Benzoylbenzoesäure anfallende Aluminiumsalz kann mit H2SO4 in Anthrachinon überführt werden.[5]
Der einfachste Anthrachinonfarbstoff Alizarin wird durch Alkalischmelze von Anthrachinon-2-sulfonsäure erhalten.[18]
Einzelnachweise
Bearbeiten- ↑ a b c Eintrag zu 2-Benzoylbenzoic Acid bei TCI Europe, abgerufen am 1. April 2019.
- ↑ a b c d Datenblatt 2-Benzoylbenzoesäure bei Sigma-Aldrich, abgerufen am 1. April 2019 (PDF).
- ↑ Carl L. Yaws: Thermophysical Properties of Chemicals and Hydrocarbons, 2nd Edition. Elsevier Inc., Amsterdam, NL 2014, ISBN 978-0-323-28659-6, S. 325.
- ↑ a b Datenblatt 2-Benzoylbenzoic Acid bei Fisher Scientific, abgerufen am 1. April 2019 (PDF).
- ↑ a b G. Heller: Über die Möglichkeit der technischen Darstellung von Anthrachinon aus Benzoylbenzoesäure. In: Angew. Chem. Band 19, Nr. 15, 1906, S. 669–670, doi:10.1002/ange.19060191504.
- ↑ Patent DE4130725A1: Verfahren zur Herstellung von 2-Benzoylbenzoesäuren. Angemeldet am 16. September 1991, veröffentlicht am 18. März 1993, Anmelder: BASF AG, Erfinder: J. Pfister, M. Schiessl, R. Kemper.
- ↑ Patent US4379092: Process for the preparation of anthraquinone and its substituted derivatives. Angemeldet am 24. November 1981, veröffentlicht am 4. Mai 1983, Anmelder: PCUK Produits Chimiques Ugine Kuhlmann, Erfinder: M. Devic.
- ↑ Patent US4591460: Process for the decomposition of a complex of orthobenzoyl-benzoic acid, hydrogen fluoride and boron trifluoride. Angemeldet am 19. März 1984, veröffentlicht am 7. Mai 1986, Anmelder: Atochem, Erfinder: M. Devic.
- ↑ Wilfred L.F. Armarego, Christina L.L. Chai: Purification of Laboratory Chemicals, 6th Edition. Elsevier, Amsterdam 2009, ISBN 978-1-85617-567-8, S. 242.
- ↑ H. Schmid, M. Hochweber, H. v. Halban: Über die Anhydride der Benzil-o-carbonsäure und der Benzoylbenzoesäure. In: Helv. Chim. Acta. Band 31, Nr. 2, 1948, S. 354–360, doi:10.1002/hlca.19480310207.
- ↑ SpeedCure: MBB, Technical Data Sheet. Lambson Ltd., 1. August 2008, abgerufen am 18. April 2019.
- ↑ P.B. Jones, M.P. Pollastri, N.A. Porter: 2-Benzoylbenzoic acid: A photolabile mask for alcohols and thiols. In: J. Org. Chem. Band 61, Nr. 26, 1996, S. 9455–9461, doi:10.1021/jo961638p.
- ↑ F. Ullmann: Ueber Reduction der o-Benzoylbenzoesäure. In: Liebigs Ann. Chem. Band 291, Nr. 1, 1896, S. 17–25, doi:10.1002/jlac.18962910105.
- ↑ Marshall Sittig: Pharmaceutical Manufacturing Encyclopedia, 3rd Edition, Volume 4. William Andrew Publ., Norwich, N.Y., U.S.A. 2007, ISBN 978-0-8155-1526-5, S. 2925–2927.
- ↑ M.R. Bodireddy, K. Krishnaiah, P.K. Babu, C. Bitra, M.R. Gujala, P. Kumar: Old is gold? Nefopam hydrochloride, a non-opioid and non-steroidal analgesic drug and its practical one-pot synthesis in a single solvent for large-scale production. In: Org. Process Res. Dev. Band 21, Nr. 11, 2017, S. 1745–1751, doi:10.1021/acs.oprd.7b00228.
- ↑ A. Behr, W.A. van Dorp: Ueberführung von β-Benzoylbenzöesäure in Anthrachinon. In: Ber. Dtsch. Chem. Ges. Band 7, Nr. 1, 1874, S. 578–579, doi:10.1002/cber.187400701182.
- ↑ C. Liebermann: Synthese der Anthrachinonsulfosäure. In: Ber. Dtsch. Chem. Ges. Band 7, Nr. 1, 1874, S. 805, doi:10.1002/cber.187400701255.
- ↑ H. Caro, C. Graebe, C. Liebermann: Ueber Fabrikation von künstlichem Alizarin. In: Ber. Dtsch. Chem. Ges. Band 3, Nr. 1, 1870, S. 359–360, doi:10.1002/cber.187000301122.
