3-Phenylphthalid
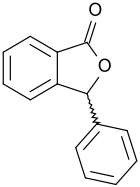
3-Phenylphthalid ist ein aromatisches γ-Lacton mit einem Isobenzofuran-Grundgerüst und der einfachste Vertreter der 3-Arylphthalide, von denen einige interessante pharmakologische Eigenschaften besitzen.[6] Bei den konventionellen Syntheserouten entsteht das chirale 3-Phenyl-1(3H)-isobenzofuranon als Racemat.
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | 3-Phenylphthalid | ||||||||||||||||||
| Andere Namen |
| ||||||||||||||||||
| Summenformel | C14H10O2 | ||||||||||||||||||
| Kurzbeschreibung | |||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 210,22 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
fest | ||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Löslichkeit |
löslich in vielen organischen Lösungsmitteln, wie z. B. Tetrahydrofuran und Toluol[3], 1,4-Dioxan[4] oder 1,2-Dichlorethan[5] | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | |||||||||||||||||||
Vorkommen und Darstellung
BearbeitenSynthese aus 2-Carboxybenzaldehyd (Phthalaldehydsäure)
BearbeitenNach einer Veröffentlichung aus dem Jahr 1908 fällt 3-Phenylphthalid bei der Umsetzung von 2-Carboxybenzaldehyd (als 3-Hydroxyphthalid) mit einem großen Überschuss der Grignard-Verbindung Phenylmagnesiumiodid an.[7]
Die Reaktion von Phthalaldehydsäure mit Benzol in Gegenwart von konzentrierter Schwefelsäure bei Raumtemperatur erzeugt 3-Phenyl-1(3H)-isobenzofuranon innerhalb einer Stunde in praktisch quantitativer Rohausbeute und 86%iger Reinausbeute.[8]
Die anspruchslosen Reaktionsbedingungen und hohen Ausbeuten machen diese Synthese zu einer brauchbaren Route zur Darstellung von racemischem 3-Phenylphthalid.
Synthese aus 2-Formylbenzoesäureestern
BearbeitenStatt aus Phthalaldehydsäure kann 3-Phenylphthalid auch aus ihren Estern, den 2-Formylbenzoesäureestern, auf dem Wege einer Palladium-[9][4] in bis zu 97%iger Ausbeute oder durch Rhodium-[3] katalysierten Arylierung mit aromatischen Boronsäuren in bis zu 94%iger Ausbeute dargestellt werden.
In Gegenwart des Katalysators Allylpalladium(II)chlorid dimer – [Pd(allyl)Cl]2 – und eines Thioether-imidazoliumchlorid-Liganden sowie der Base Caesiumfluorid werden bei der Umsetzung von 2-Formylbenzoesäuremethylester mit Phenylboronsäure in Dioxan Ausbeuten von racemischem 3-Phenyl-1(3H)-isobenzofuranon bis zu 99 % erzielt.
Wegen der teuren Katalysatoren und Liganden sowie teilweise bedenklichen Lösungsmitteln, z. B. 1,4-Dioxan, lohnen diese Reaktionsvarianten eher zum Aufbau komplizierterer 3-Arylphthalide.
Die Rhodium(I)-katalysierte Addition von Phenylboronsäure an 2-Formylbenzoate in Gegenwart chiraler Phosphitliganden führt ebenfalls in hoher Ausbeute (94 %), aber relativ niedrigem Enantiomerenüberschuss (71 % ee) zu chiralem 3-Phenylphthalid.[3]
Synthese aus 2-Benzoylbenzoesäure
BearbeitenBereits im Jahr 1876 wurde von Theodor Zincke die Darstellung des damals noch als β-Benzhydrylbenzoesäureanhydrid bezeichneten 3-Phenylphthalids – aus der einfach durch Friedel-Crafts-Acylierung von Benzol mit Phthalsäureanhydrid zugänglichen[10] – Anthrachinon-Vorstufe 2-Benzoylbenzoesäure durch Reduktion mit Zink und Salzsäure berichtet.[11]
Eine Verbesserung dieser Reaktion ist die von Fritz Ullmann vorgeschlagene Verwendung von Eisessig statt Salzsäure, bei der eine quantitative Ausbeute an 3-Phenylphthalid erzielt wird.[12]
Bei der zehnfachen Vergrößerung des Ansatzes wird eine Reinausbeute von 77 % erhalten.[13]
Aus dem Arbeitskreis von Herbert Charles Brown wurde die erste enantioselektive Synthese von 3-Phenyl-1(3H)-isobenzofuranon mit dem chiralen Boran Diisopinocampheylboran (+)-Di-3-pinanylboran[14] berichtet.[15]
Nach oxidativer Spaltung der Boranverbindung und Behandlung mit Dimethylsulfat wird bei einer Produktausbeute von 71 % das R-Isomer von 3-Phenylphthalid mit einem sehr hohen Enantiomerenüberschuss (ee >96 %) erhalten.
Synthese aus Phthalaldehyd
BearbeitenEine neuere Alternativroute zu 3-Phenylphthalid und 3-Arylphthaliden geht aus von Phthalaldehyd, der mit Phenylboronsäure, Cyclooctadien-Rhodiumchlorid-Dimer als Katalysator, dem Diphosphin-Liganden dppb und der Base Kaliumcarbonat das Produkt in 83%iger Ausbeute liefert.[5]
Eine Variante dazu ist die Cobalt-katalysierte Reaktion mit Cobalt(II)-iodid, dem Diphosphin-Liganden 1,2-Bis(diphenylphosphino)ethan und der Base K2CO3, die 3-Phenyl-1(3H)-isobenzofuranon in 89%iger Ausbeute ergibt.[16]
Auch diese übergangsmetall-katalysierten Synthesevarianten scheinen sich eher für den Aufbau komplizierterer 3-Arylphthalide zu eignen, bei denen empfindliche funktionelle Gruppen die harschen Reaktionsbedingungen der älteren Prozesse nicht tolerieren.
Eigenschaften
Bearbeiten3-Phenylphthalid ist ein weißer, kristalliner Feststoff, der in Wasser praktisch unlöslich ist, sich aber in einer Vielzahl von organischen Lösungsmitteln löst. Die chirale Verbindung fällt bei älteren Syntheserouten ohne den Einsatz chiraler Katalysatoren als Racemat an.
Anwendungen
BearbeitenDas bei der Reaktion mit Kaliumamid in flüssigem Ammoniak mit 3-Phenyl-1(3H)-isobenzofuranon entstehende Carbanion reagiert mit Kohlendioxid (Trockeneis) unter Bildung der Lactoncarbonsäure 3-Phenylphthalid-3-carbonsäure in 87%iger Ausbeute.[13] Das Carbanion reagiert mit Benzylchlorid zum 3-Benzyl- und mit Benzoylchlorid zum 3-Benzoylderivat und addiert Acrylnitril zum entsprechenden Cyanethylierungsprodukt.
Die Umsetzung der 3-Phenylphthalid-Vorstufe 2-Benzoylbenzoesäure mit Thionylchlorid erzeugt 3-Chlor-3-phenylphthalid[17], das mit tert-Butylhydroperoxid zu 3-tert-Butylperoxy-3-phenylphthalid[18] reagiert.
Die Peroxyverbindung findet als Radikalstarter bei radikalisch initiierten Polymerisationen und als Vernetzer von Polymeren[19] Verwendung.
Eine klassische Mehrstufensynthese einiger Modellsubstanzen für ZNS-aktiven Benzazepine geht aus von 3-Phenylphthalid, das mit Acetonitril und Natriumamid zum Lactol reagiert, das wiederum mit Dimethylformamid-dimethylacetal (DMF-DMA) ringgeöffnet wird. Die Reaktion mit Guanidin bildet ein 2-Aminopyrimidin. Die sekundäre Alkoholgruppe am Benzolring wird mit Mangandioxid zum Keton oxidiert und durch hydrierende Cyclisierung der Benzazepin-Ring geschlossen.[20]
Einzelnachweise
Bearbeiten- ↑ a b c Datenblatt tert-Butyl carbamate bei Sigma-Aldrich, abgerufen am 10. September 2017 (PDF).
- ↑ a b Eintrag zu 3-Phenylphthalide bei TCI Europe, abgerufen am 20. September 2017.
- ↑ a b c C.-H. Xing, Y.-X. Liao, P. He, Q.-S. Hu: Transition metal-catalyzed addition reactions of arylboronic acids with alkyl 2-formylbenzoates: efficient access to chiral 3-substituted phthalides. In: Chem. Commun. Band 46, 2010, S. 3010–3012, doi:10.1039/c001104e.
- ↑ a b M. Kuriyama, N. Ishiyama, R. Shimazawa, R. Shirai, O. Onomura: Efficient synthesis of 3-arylphthalides using palladium-catalyzed arylation of aldehydes with organoboronic acids. In: J. Org. Chem. Band 74, Nr. 23, 2009, S. 9210–9213, doi:10.1021/jo901964k.
- ↑ a b Z. Ye, G. Lv, W. Wang, M. Zhang, J. Cheng: Rhodium-catalyzed cascade reaction: Aryl addition/intramolecular esterification to access 3-aryl and 3-alkenyl phthalides. In: Angew. Chem. Band 122, 2010, S. 3753–3756, doi:10.1002/ange.201000302.
- ↑ R. Karmarkar, P. Pahari, D. Mal: Phthalides and phthalans: Synthetic methodologies and their applications in the total synthesis. In: Chem. Rev. Band 114, Nr. 12, 2014, S. 6213–6284, doi:10.1021/cr400524q.
- ↑ E. Mermod, H. Simonis: Ueber einige Phthalide und Mekonine. In: Chem. Ber. Band 41, Nr. 1, 1908, S. 982–985, doi:10.1002/cber.190804101191.
- ↑ V.W. Floutz: Notes - Condensation reactions of phthalaldehydic acid. In: J. Org. Chem. Band 25, Nr. 4, 1960, S. 643–645, doi:10.1021/jo01074a608.
- ↑ N. Miyaura: Celebrating 20 Years of SYNLETT - Special Account On Palladium(II)-Catalyzed Additions of Arylboronic Acids to Electron-Deficient Alkenes, Aldehydes, Imines, and Nitriles. In: Synlett. Band 13, 2009, S. 2039–2050, doi:10.1055/s-0029-1217555k.
- ↑ Louis F. Fieser: Experiments in Organic Chemistry, 2nd Edition. D.C. Heath & Co., Boston, MA, U.S.A. 1941, S. 184–187.
- ↑ F. Rotering, T. Zincke: Ueber β-Benzhydrylbenzoesäureanhydrid und über β-Benzylbenzoesäure. In: Chem. Ber. Band 9, Nr. 1, 1876, S. 631–640, doi:10.1002/cber.187600901193.
- ↑ F. Ullmann: Ueber Reduction der o-Benzoylbenzoesäure. In: Liebigs Ann. Chem. Band 291, Nr. 1, 1896, S. 17–25, doi:10.1002/jlac.18962910105.
- ↑ a b C.R. Hauser, M.T. Tetenbaum, D.S. Hoffenberg: Condensations Involving the Metalation of the 3-Position of 3-Phenylphthalide by Means of Alkali Amides. Carbonation of Phthalide. In: J. Org. Chem. Band 23, Nr. 6, 1958, S. 861–865, doi:10.1021/jo01100a026.
- ↑ R.K. Dhar et al.: Diisopinocampheylborane. In: e-EROS Encyclopedia of Reagents for Organic Synthesis. 2015, doi:10.1002/047084289X.rd248.pub3.
- ↑ P.V. Ramachandran, G.-M. Chen, H.C. Brown: Efficient general asymmetric syntheses of 3-substituted 1(3H)-Isobenzofuranones in very high enantiomeric excess. In: Tetrahedron Lett. Band 37, Nr. 13, 1996, S. 2205–2208, doi:10.1016/S0040-4039(96)00260-2.
- ↑ J. Karthikeyan, K. Parthasarathy, C.-H. Cheng: Synthesis of biarylketones and phthalides from organoboronic acids and aldehydes catalyzed by cobalt complexes. In: Chem. Commun. Band 47, 2011, S. 10461–10463, doi:10.1039/C1CC13771A.
- ↑ F.N. Jones, C.R. Hauser: Synthesis of 3-substituted 3-phenylphthalides. In: J. Org. Chem. Band 27, Nr. 9, 1962, S. 3364–3365, doi:10.1021/jo01056a540.
- ↑ Patent US3654315: Organic pseudo peresters. Angemeldet am 3. Juni 1969, veröffentlicht am 4. April 1972, Anmelder: Reichhold Chemicals, Inc., Erfinder: Y.G. Chang, P.S. Bailey.
- ↑ Patent US4322273: Process for cross-linking shaped non-polar synthetic resins and electrical insulation containing such resins. Angemeldet am 27. August 1979, veröffentlicht am 30. März 1982, Anmelder: Akzona Inc., Erfinder: J.D. van Drumpt.
- ↑ J.V. Earley, R.I. Fryer, N.W. Gilman: 2-Benzazepines. 7. Synthesis of pyrimido[5,4-d][2]benzazepines. In: J. Heterocyclic Chem. Band 20, 1983, S. 1195–1197, doi:10.1002/jhet.5570200512.