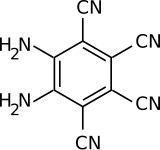
5,6-Diaminobenzo-1,2,3,4-tetracarbonitril
5,6-Diaminobenzo-1,2,3,4-tetracarbonitril ist ein organisches Molekül mit vier Cyano- und zwei Aminofunktionen. Das Molekül wurde 2016 am Max-Planck-Institut für Polymerforschung hergestellt und weist das bislang größte gemessene Dipolmoment in einem neutralen Molekül auf. Das Molekül belegte 2016 den zweiten Platz bei der Wahl des Molecule of the Year der Chemical & Engineering News.[3]
| Strukturformel | ||||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| ||||||||||
| Allgemeines | ||||||||||
| Name | 5,6-Diaminobenzo-1,2,3,4-tetracarbonitril | |||||||||
| Summenformel | C10H4N6 | |||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||
| ||||||||||
| Eigenschaften | ||||||||||
| Molare Masse | 208,15 g·mol−1 | |||||||||
| Aggregatzustand |
fest[1] | |||||||||
| Sicherheitshinweise | ||||||||||
| ||||||||||
| Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | ||||||||||
Darstellung
Bearbeiten5,6-Diaminobenzo-1,2,3,4-tetracarbonitril ist über die oxidative Bromierung von 4,5-Diaminophthalonitril erhältlich.[1] Dabei entsteht im ersten Schritt 4,5-Diamino-3,6-dibromphthalonitril, das sich unter Palladium-Katalyse mit Zinkcyanid in das Zielmolekül überführen lässt.[1]
Eigenschaften
BearbeitenMit einem Dipolmoment von 14,1 Debye ist 5,6-Diaminobenzo-1,2,3,4-tetracarbonitril die polarste nichtionische Verbindung.[4][1] In THF wurde ein Dipolmoment von 14,1 ± 0,7 Debye gemessen.[1] Damit übertrifft es sogar das Dipolmoment von typischen Salzen wie Kaliumbromid in der Gasphase, das ein Dipolmoment von 10,41 Debye aufweist.[5] Die polarste nichtionische, vollständig gesättigte Verbindung ist mit einem Dipolmoment von 6,2 Debye all-cis-1,2,3,4,5,6-Hexafluorcyclohexan.[6][7] Es ist in der Lage mit Dimethylacetamid einen Komplex zu bilden.[1]
Verwendung
BearbeitenHohe Dipolmomente bei Benzolderivaten werden durch gegenüberliegende elektronziehende und elektronenschiebende Substituenten erreicht. Diese ungeladenen Benzolderivate mit hohem Dipolmoment eignen sich eventuell als Ferroelektrikum und für Anwendungen in der nichtlinearen Optik.[8] Außerdem können solche Moleküle eventuell eine bessere Ladungstrennung in mehrschichtigen Solarzellen erreichen.
Weblinks
Bearbeiten- Katrina Krämer: A small molecule’s big moment. In: chemistryworld.com. Chemistry World, 8. Februar 2016.
Literatur
Bearbeiten- Mark Peplow: The Record Breakers. In: ACS Central Science. Band 2, Nr. 8, 2016, S. 489–492, doi:10.1021/acscentsci.6b00211.
Einzelnachweise
Bearbeiten- ↑ a b c d e f Jakob Wudarczyk, George Papamokos, Vasilis Margaritis, Dieter Schollmeyer, Felix Hinkel, Martin Baumgarten, George Floudas, Klaus Müllen: Hexasubstituted Benzenes with Ultrastrong Dipole Moments. In: Angewandte Chemie International Edition. Band 55, Nr. 9, 2016, S. 3220–3223, doi:10.1002/anie.201508249.
- ↑ Dieser Stoff wurde in Bezug auf seine Gefährlichkeit entweder noch nicht eingestuft oder eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- ↑ Steve Ritter: Molecules of the year, C&EN highlights some of the coolest compounds reported in 2016
- ↑ Stephen K. Ritter: Lopsided Benzene Sets A New Polarity Record. In: Chemical & Engineering News. 94(7), 2016, S. 23.
- ↑ Betty Isabelle Bleaney, Brebis Bleaney: Electricity and Magnetism, Volume 2 Third Edition. OUP Oxford, 2013, ISBN 978-0-19-964543-5, S. 303 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ Neil S. Keddie, Alexandra M. Z. Slawin, Tomas Lebl, Douglas Philp, David O’Hagan: All-cis 1,2,3,4,5,6-hexafluorocyclohexane is a facially polarized cyclohexane. In: Nature Chemistry. Band 7, Nr. 6, 2015, S. 483–488, doi:10.1038/nchem.2232.
- ↑ Stephen K. Ritter: Molecule Claims Most Polar Title. In: Chemical & Engineering News. 93(13), 2015, S. 5.
- ↑ Lap Tak Cheng, Wilson Tam, Sylvia H. Stevenson, Gerald R. Meredith, Geert Rikken, Seth R. Marder: Experimental investigations of organic molecular nonlinear optical polarizabilities. 1. Methods and results on benzene and stilbene derivatives. In: The Journal of Physical Chemistry. Band 95, Nr. 26, 1991, S. 10631–10643, doi:10.1021/j100179a026.