Aminopolycarbonsäuren
Die Aminopolycarbonsäuren oder Komplexone sind eine Gruppe von Komplexbildnern, welche aus einem oder mehreren stickstoffhaltigen Gruppen und mehreren Carboxygruppen bestehen.[1] EDTA und NTA werden dabei in den größten Mengen eingesetzt. EDTA ist jedoch nicht biologisch abbaubar[1] und NTA gilt als krebserregend.[2] Daher gewinnen neue Chelatoren wie Tetranatriumiminodisuccinat, Methylglycindiessigsäure und β-Alanindiessigsäure an Bedeutung.
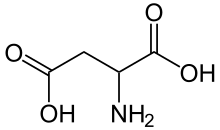
Die natürlichen Aminosäuren Asparaginsäure und Glutaminsäure sind Aminodicarbonsäuren und zählen so auch zu den Aminopolycarbonsäuren.
Sie werden für die Chelatometrie benötigt[3] und in Waschmitteln verwendet.
Natürliche Aminopolycarbonsäuren
BearbeitenEinige Lebewesen verwenden Aminopolycarbonsäuren als Siderophore. So stellen Bakterien (S,S-Enantiomer) und Pilze (R,R-E.) Rhizoferrin und Rhizobactine her. Bei den Süßgräsern nutzt Hafer die Aveninsäure[4] und Gerste die Mugineinsäure[5] um Eisen aus dem Boden aufzunehmen.[6] Bei praktisch allen höheren Pflanzen ist Nicotianamin vorhanden.[7]
-
Rhizoferrin
-
Rhizobactin DM4
-
Rhizobactin 1021
-
Mugineinsäure
-
Aveninsäure
Diese bilden teilweise deutlich stabilere Komplexe mit Eisen als die synthetischen Aminopolycarbonsäuren.
Synthetische Aminopolycarbonsäuren
BearbeitenEinzelnachweise
Bearbeiten- ↑ a b Margarete Bucheli-Witschel, Thomas Egli: Environmental fate and microbial degradation of aminopolycarboxylic acids. In: FEMS Microbiology Reviews. Band 25, Nr. 1, Januar 2001, S. 69–106, doi:10.1111/j.1574-6976.2001.tb00572.x.
- ↑ Zahmer Teufel. In: Der Spiegel. Nr. 42, 1971, S. 198 (online – 11. Oktober 1971).
- ↑ Complexometric Titration with Aminopolycarboxylic Acids (EDTA and Analogs). Abgerufen am 11. Juli 2014.
- ↑ Shinji Fushiya, Yoshikazu Sato, Shigeo Nozoe, Kyosuke Nomoto, Tsunematsu Takemoto, Sei-ichi Takagi: Avenic acid, a new amino acid possessing an iron chelating activity. In: Tetrahedron Letters. Band 21, Nr. 32, Januar 1980, S. 3071–3072, doi:10.1016/s0040-4039(00)77410-7.
- ↑ Mugineic acid, a phytosiderophore
- ↑ Waldemar Ternes: Biochemie der Elemente: Anorganische Chemie biologischer Prozesse. Springer DE, 2013, ISBN 3-8274-3020-8, S. 115 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ Miloš Buděšínský, Herbert Budzikiewicz, Želimír Procházka, Helmut Ripperger, Axel Römer, Günter Scholz, Klaus Schreiber: Nicotianamine, a possible phytosiderophore of general occurrence. In: Phytochemistry. Band 19, Nr. 11, Januar 1980, S. 2295–2297, doi:10.1016/s0031-9422(00)91014-8.
- ↑ G. Schwarzenbach, E. Kampitsch, R. Steiner: Komplexone II. Das Komplexbildungsvermögen von Iminodiessigsäure, Methylimino-diessigsäure, Aminomalonsäure und Aminomalonsäure-diessigsäure. In: Helvetica Chimica Acta. Band 28, Nr. 1, 1945, S. 1133–1143, doi:10.1002/hlca.194502801158.
- ↑ a b c Giorgio Anderegg, Francoise Arnaud-Neu, Rita Delgado, Judith Felcman, Konstantin Popov: Critical evaluation of stability constants of metal complexes of complexones for biomedical and environmental applications* (IUPAC Technical Report). In: Pure and Applied Chemistry. 77, 2005, doi:10.1351/pac200577081445.