Bisphenol-A-bis(phthalsäureanhydrid)
Bisphenol-A-bis(phthalsäureanhydrid) (BPADA) ist eine organische chemische Verbindung und ein Dianhydrid. Es besteht aus einem Bisphenol-A-Molekül, das über Ether-Brücken mit zwei Phthalsäureanhydridmolekülen verbunden ist.
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
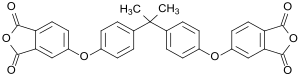
| |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Bisphenol-A-bis(phthalsäureanhydrid) | ||||||||||||||||||
| Andere Namen |
| ||||||||||||||||||
| Summenformel | C31H20O8 | ||||||||||||||||||
| Kurzbeschreibung |
weißes bis blassgelbes Kristallpulver[1] oder cremefarbene[2] bis gelbe Körnchen[3] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 520,49 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
fest | ||||||||||||||||||
| Dichte | |||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Siedepunkt | |||||||||||||||||||
| Löslichkeit |
praktisch unlöslich in Wasser, löslich in DMAC[4] und Dimethylformamid | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Toxikologische Daten | |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | |||||||||||||||||||
BPADA ist ein wichtiges Monomer für Polyetherimide[4] und Polyimide, welche den Hochleistungskunststoffen zugeordnet werden.[5] Bisphenol-A-bis(phthalsäureanhydrid) ist außerdem Ausgangsstoff für Bisphenol-A-tetracarbonsäure, die kürzlich unter der Bezeichnung „Lockdown“ als Inhibitor der Phosphatase PPM1F beschrieben wurde und die Metastasierung von Tumorzellen verhindern soll.[6]
Vorkommen und Darstellung
BearbeitenIm Labormaßstab lässt sich Bisphenol-A-bis(phthalsäureanhydrid) aus dem Dinatriumsalz des Bisphenol A (BPA) mit einem in 4-Stellung halogensubstituierten Phthalsäureanhydrid, wie z. B. 4-Fluorphthalsäureanhydrid, erhalten.[7][8]
Unter Mitwirkung des Phasentransferkatalysators Hexaethylguanidiniumchlorid entsteht BPADA in einer Williamson-Ethersynthese in 90%iger Ausbeute.
Die Synthese von 4,4′-Bisphenol-A-bis(phthalsäureanhydrid) im industriellen Maßstab geht von N-Methylphthalimid[9] aus (aus Phthalsäureanhydrid und Methylamin), gefolgt von anschließender Nitrierung (mit Nitriersäure) zum N-Methyl-4-nitrophthalimid (4-NPI).[10] Dabei entstehen auch geringe Mengen des 3-Isomers, das jedoch einfach abgetrennt werden kann.[11] Bei der Reaktion des 4-NPI mit dem Natriumsalz des Bisphenol A wird das Bis(phthalimid) gebildet, das zur Tetracarbonsäure hydrolysiert und dann (z. B. mit Eisessig/Acetanhydrid-Gemisch) zum Dianhydrid dehydratisiert wird.[12]
Eine verkürzte Prozessführung überführt das Bisphenol-A-bisphthalimid in einer Imid-Anhydrid-Austauschreaktion in das Bisphenol-A-bis(phthalsäureanhydrid). Die Reaktion findet in wässriger Phthalsäurelösung statt und wird katalysiert durch ein tertiäres Amin, wie z. B. Dimethylbutylamin.[13]
Eigenschaften
BearbeitenBisphenol-A-bis(phthalsäureanhydrid) ist in reiner Form ein weißes Kristallpulver, das praktisch unlöslich in Wasser ist. Es löst sich in aprotisch dipolaren Lösungsmitteln, wie z. B. Dimethylformamid und Dimethylacetamid. In Alkalien löst es sich unter Bildung des Salzes der 4,4′-Bisphenol-A-tetracarbonsäure.
Anwendungen
BearbeitenBisphenol-A-bis(phthalsäureanhydrid) wird wegen seiner difunktionellen cyclischen Carbonsäureanhydridstruktur als Härter für wärmebeständige Epoxidharze verwendet[14][4] und für Polyimide.[5] Es ist außerdem ein wichtiger Molekülbaustein für Polyetherimide (PEI), z. B. bei Reaktion mit p-Phenylendiamin (PPD):
Zur Erzielung hoher Molmassen mit verbesserten Eigenschaften (wie Farbe, Transparenz, Wasseraufnahme usw.) ist hochreines BPADA und exakte Stöchiometrie der Reaktanden erforderlich (da es sich bei der Polymerisation um eine Polykondensation handelt). Analog zur Bildung des AH-Salzes bei der Herstellung von Nylon 6.6 kann die durch Hydrolyse von BPADA erhaltene Bisphenol-A-tetracarbonsäure mit Diaminen zu einem stöchiometrischen Salz umgesetzt werden, welches bei Temperaturen um 200 °C zu hochmolekularen Polyimiden reagiert.[15]
BPADA verleiht den daraus hergestellten Polymeren vorteilhafte Eigenschaften, wie gute Löslichkeit in organischen Lösungsmitteln (z. B. NMP, DMAC, Chloroform und THF)[16], die den Einsatz in temperaturbeständigen Lacken, Beschichtungen und Folien ermöglichen. Geringe Wasseraufnahme, niedrige Dielektrizitätskonstante, sowie hohe Transparenz und Adhäsion auf Metalloberflächen, insbesondere im Vergleich zum Standarddianhydrid Pyromellitsäuredianhydrid (PMDA), machen BPADA für Elektronikanwendungen besonders geeignet.
Bisphenol-A-bis(phthalsäureanhydrid) und die daraus abgeleiteten Polyimide unter dem Markennamen UltemTM, z. B. Ultem 1000 mit dem Diamin m-Phenylendiamin oder Ultem 5000 mit p-Phenylendiamin, wurden von der General Electric Co. entwickelt und werden inzwischen von SABIC produziert und vermarktet.
Eine kürzlich erschienene Publikation[6] berichtet über die in-vitro-Aktivität des BPADA-Hydrolyseprodukts BPADA-tetracarbonsäure (hier „Lockdown“ genannt) als Inhibitor für die in Tumorzellen häufig in großen Mengen produzierte Phosphatase PPM1F. Die durch körpereigene Esterasen vermittelte Hydrolyse der besser membrangängigen Vorstufe BPADA-tetracarbonsäure-tetraethylester (hier als „LockdownPro“ bezeichnet) liefert den Wirkstoff BPADA-tetracarbonsäure. BPADA-tetracarbonsäure soll als wirksamer PPM1F-Inhibitor die Ausbreitung von Tumorzellen blockieren. Weitere Untersuchungen sollten die in-vivo-Wirksamkeit solcher polyvalenter Vernetzer belegen und mögliche Therapieansätze zur Verhinderung der Metastasierung von Tumoren aufzeigen.
Einzelnachweise
Bearbeiten- ↑ a b c d Eintrag zu 4,4'-(4,4'-Isopropylidenediphenoxy)diphthalic Anhydride bei TCI Europe, abgerufen am 23. April 2022.
- ↑ Eintrag zu 4,4'-[(Isopropyliden)bis(p-phenylenoxy)]diphthaldisäureanhydrid in der GESTIS-Stoffdatenbank des IFA, abgerufen am 23. April 2022. (JavaScript erforderlich)
- ↑ a b c d e f Datenblatt 4,4′-(4,4′-Isopropylidenediphenoxy)bis(phthalic anhydride) bei Sigma-Aldrich, abgerufen am 23. April 2022 (PDF).
- ↑ a b c J.-H. Chang: Equibiaxially stretchable colorless and transparent polyimides for flexible display substrates. In: Rec. Adv. Mater. Sci. Eng. Band 59, 2020, S. 1–9, doi:10.1515/rams-2020-0003.
- ↑ a b A. E. Eichstadt, T. C. Ward, M. D. Bagwell, I. V. Farr, D. L. Dunson, J. E. McGrath: Synthesis and characterization of amorphous partially aliphatic polyimide copolymers based on bisphenol-A dianhydride. In: Macromolecules. 2022, doi:10.1016/j.chembiol.2022.03.011.
- ↑ a b T.M. Grimm, M. Herbinger, L. Krüger, S. Müller, T.U. Mayer, C.R. Hauck: Lockdown, a selective small-molecule inhibitor of the integrin phosphatase PPM1F, blocks cancer cell invasion. In: Cell Chem. Biol. 2022, doi:10.1016/j.chembiol.2022.03.011.
- ↑ W.T. Schwartz: A novel route to aryl diether dianhydrides. In: High Perf. Polym. Band 2, Nr. 3, 1990, S. 189–196, doi:10.1177/152483999000200304.
- ↑ Patent US20060205958A1: Direct dianhydride synthesis. Angemeldet am 11. März 2005, veröffentlicht am 14. September 2006, Anmelder: General Electric Co., Erfinder: D.J. Brunelle, J.A. Cella, Q. Ye, K.P. Chan.
- ↑ Externe Identifikatoren von bzw. Datenbank-Links zu N-methylphthalimide: CAS-Nr.: 550-44-7, EG-Nr.: 208-982-4, ECHA-InfoCard: 100.008.167, GESTIS: 105087, PubChem: 11074, ChemSpider: 10603, Wikidata: Q27263715.
- ↑ F.J. Williams, P.E. Donahue: Nitration of N-alkylphthalimides. In: J. Org. Chem. Band 43, Nr. 8, 1978, S. 1608–1610, doi:10.1021/jo00402a036.
- ↑ Patent US4048190: Preparation of bisphenol-A bisimides. Angemeldet am 17. Februar 1976, veröffentlicht am 13. September 1977, Anmelder: General Electric Co., Erfinder: D.S. Johnson, F.J. Williams, III.
- ↑ Patent US3879428: Method for making aromatic bis(ether anhydride)s. Angemeldet am 30. März 1973, veröffentlicht am 22. April 1975, Anmelder: General Electric Co., Erfinder: D.R. Heath, T. Takekoshi.
- ↑ Patent US4584388: Method and composition for preparing aromatic polycarboxylic acids and their anhydrides from polycarboximides. Angemeldet am 14. Januar 1985, veröffentlicht am 22. April 1986, Anmelder: General Electric Co., Erfinder: J.L. Webb.
- ↑ Achieving high heat epoxy formulations using BISDA. In: Version 1.0. SABIC’s Specialties Business Thermosets & Additives, 2019, abgerufen am 23. April 2022.
- ↑ Kevin J. Bigham: RESINATE No.7: Focus on Polyimides. Zeus Industrial Products, Inc., Juli 2007, abgerufen am 23. April 2022.
- ↑ Building polyimide varnishes and films using high purity BPADA. In: SD1100P Powder Technical Bulletin. SABIC’s Specialties Business, Thermosets & Additives, 2021, abgerufen am 23. April 2022.
