Cryptophycine
Die Cryptophycine sind eine Familie zum Teil stark cytotoxischer und antibiotisch wirksamer, makrocyclischer Depsipeptide.
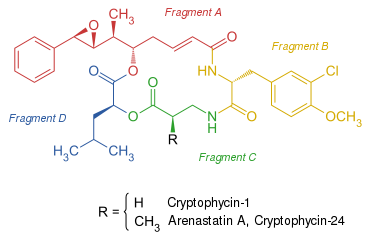
Cryptophycine bestehen aus vier Bausteinen, zwei Amino- und zwei Hydroxysäuren.[1] Einer der Hydroxysäure-Bausteine (Fragment A) ist polyketidischen Ursprungs und weist je nach Cryptophycin bis zu vier stereogene Zentren auf.
Geschichte
BearbeitenCryptophycine wurden das erste Mal 1990 beschrieben. R. Schwartz von Merck isolierte die Substanz Cryptophycin-1 aus Cyanobakterien der Gattung Nostoc. Die Verbindung zeigte eine starke abtötende Wirkung gegenüber Hefen der Gattung Cryptococcus, was zur Namensgebung führte.
Weiteres Interesse an dieser Verbindungsklasse weckten die Arbeiten von R. Moore, welche sich neben der Reinigung des Naturstoffs aus Cyanobakterien der Gattung Nostoc auch mit der Strukturaufklärung und dem Potential dieser Verbindungen zum Einsatz in einer Chemotherapie befassten.[2][3]
I. Kitagawa von der Universität von Osaka entdeckte im Rahmen seiner Forschungen unabhängig von R. Schwartz und R. Moore Mitglieder derselben Peptidfamilie im Meeresschwamm Dysidea arenaria, welche er als Arenastatine bezeichnete. Er war der Erste, der die Struktur eines Vertreters dieser Verbindungsklasse aufklärte.[4] D. Sherman von der Universität Michigan klärte die Herstellung der Cryptophycine in Nostoc auf.
Eigenschaften
BearbeitenCryptophycine besitzen teilweise eine außergewöhnlich hohe Zytotoxizität. Die IC-50-Werte erreichen dabei den niedrigen picomolaren Bereich und liegen damit erheblich unterhalb jener von Wirkstoffen mit vergleichbaren Wirkmechanismen wie beispielsweise Paclitaxel. Die Wirksamkeit von Cryptophycin-1 bleibt angesichts medikamentenresistenter Tumorzelllinien weitgehend erhalten und nahm im Versuch nur um den Faktor 6 ab, während sie bei Vinblastin um das 100-fache und bei Paclitaxel sogar um das 500-fache sank.
Wie bei Vinblastin und Paclitaxel beruht die Wirkung der Cryptophycine auf der Bindung an Tubulin.[5][6] Cryptophycine stören dadurch die korrekte Ausbildung des Zytoskeletts und führen zur Apoptose.[7][8] Ursächlich für die Wirksamkeit ist die dadurch hervorgerufene Veränderung der dynamische Instabilität der Mikrotubuli,[9] wodurch ein korrekter Aufbau des Spindelapparats während der Mitose nicht mehr gewährleistet ist. Hierdurch wird die Zellteilung unterbrochen und die Zelle verharrt in einem Prometaphase/Metaphase-artigen Zustand, bevor die Apoptose eingeleitet wird und die Zelle stirbt.
Als Depsipeptide enthalten Cryptophycine hydrolyseempfindliche Esterbindungen, sowie die meisten biologisch aktiven Cryptophycine darüber hinaus eine hydrolyseempfindliche Epoxid-Funktion oder ein nur bedingt stabiles Derivat derselben, daher müssen sie bei Tier- und Menschenversuchen injiziert werden, um eine hinreichende Bioverfügbarkeit sicherzustellen.
Gewinnung und Darstellung
BearbeitenDie Gewinnung aus Cyanobakterien der Gattung Nostoc und aus dem Meeresschwamm Dysidea arenaria war nur anfänglich von Bedeutung. Mittlerweile existieren eine Vielzahl chemischer Synthesen.[10][11][12] Versuche zur biotechnologischen Produktion von Cryptophycinen wurden unternommen,[13][14] fanden aber bislang keine weitere Verbreitung.
Verwendung
BearbeitenDie Firma Eli Lilly untersuchte die Eignung verschiedener Cryptophcyine für die Chemotherapie von Krebserkrankungen in klinischen Studien der Phasen 1 und 2,[15] deren Ergebnisse zwischen 2002 und 2006 veröffentlicht wurden. Bislang existiert noch kein Medikament auf Basis der Cryptophycin-Leitstruktur.
Literatur
Bearbeiten- R. E. Schwartz, C. F. Hirsch, D. F. Sesin, J. E. Flor, M. Chartrain, R. E. Fromtling, G. H. Harris, M. J. Salvatore, J. M. Liesch, K. Yudin: Pharmaceuticals from Cultured Algae. In: J. Ind. Microbiol., 1990, 5, S. 113–124.
- C. Sessa, K. Weigang-Kohler, O. Pagani, G. Greim, O. Mor, T. DePas, M. Burgess, I. Weimer, R. Johnson: Phase I And Pharmacological Studies of the Cryptophycin Analogue LY355703 Administered on a Single Intermittent or Weekly Schedule. In: Eur. J. Cancer, 2002, 38, S. 2388–2396.
- G. D’Agostino, J. DelCampo, B. Mellado, M. A. Izquierdos, T. Minarik, L. Cirri, L. Marini, J. L. Perez-Gracia, G. Scambia: A Multicenter Phase II Study of the Cryptophycin Analog LY355703 in Patients with Platinum-Resistant Ovarian Cancer. In: Int. J. Gynecol. Cancer, 2006, 16, S. 71–76.
- M. Nahrwold, S. Eißler, N. Sewald: Cryptophycins – Highly cytotoxic depsipeptides. highlights, challenges, and recent advances. In: Focus on Peptide - Supplement to Chimica Oggi, 2008, 26, 4, S. 13–16.
- M. Eggen, G. I. Georg: The cryptophycins: Their synthesis and anticancer activity. In: Med. Res. Rev. 2002, 22, S. 85–101.
- E. Hamel, D. G. Covell: Antimitotic Peptides and Depsipeptides. In: Curr. Med. Chem., 2002, 2, S. 19–53.
- M. A. Tius: Synthesis of the cryptophycins. In: Tetrahedron, 2002, 58, S. 4343–4367.
- R. S. Al-awar, T. H. Corbett, J. E. Ray, L. Polin, J. H. Kennedy, M. M.Wagner, D. C. Williams: Biological Evaluation of Cryptophyin-52 Fragment A Analogues: Effect of the Multidrug Resistance ATP Binding Cassette Transporters on Antitumor Activity. In: Mol. Cancer Ther., 2004, 4, S. 1061–1067.
- B. D.-M. Chen, A. Nakeff, F. Valeriote: Cellular Uptake of a Novel Cytotoxic Agent, Cryptophyin-52, by Human THP-1 Leukemia Cells and H-125 Lung Tumor Cells. In: Int. J. Cancer, 1998, 77, S. 869–873.
- K. Kerksiek, M. R. Mejillano, R. E. Schwartz, G. I. George, R. H. Himes: Interaction of Cryptophycin-1 with Tubulin and Microtubules. In: FEBS Lett., 1995, 377, S. 59–61.
- C. D. Smith, X. Zhang: Mechanism of Action of Cryptophycin. In: J. Biol. Chem., 1996, 271, S. 6192–6198.
- C. Shih, B. A. Teicher: Cryptophycins: A Novel Class of Potent Antimitotic Antitumor Depsipeptides. In: Curr. Pharm. Des., 2001, 7, S. 1259–1276.
Weblinks
Bearbeiten- Stefan Eißler: Synthese von Cryptophycinen für SAR-Studien. Dissertation, Uni Bielefeld, 2008, urn:nbn:de:hbz:361-13019.
- Markus Nahrwold: [beta]2-Aminosäuren als Bausteine funktionalisierter Cryptophycin-Analoga. Dissertation, Uni Bielefeld, 2009, urn:nbn:de:hbz:361-16733.
Einzelnachweise
Bearbeiten- ↑ C. Weiss, B. Sammet, N. Sewald: Recent approaches for the synthesis of modified cryptophycins. In: Nat Prod Rep., 2013, Band 30, Nr. 7, S. 924–940. doi:10.1039/c3np70022d. PMID 23732943.
- ↑ G. Trimurtulu, I. Ohtani, G. M. L. Patterson, R. E. Moore, T. H. Corbett, F. A. V. L. Demchik: Total Structures of Cryptophycins, Potent Antitumor Depsipeptides from the Blue-Green Alga Nostoc sp. Strain GSV 224. In: J. Am. Chem. Soc. 1994, 116, S. 4729–4737.
- ↑ C. D. Smith, X. Zhang, S. Mooberry, G. M. Patterson, R. Moore: Cryptophycin: A New Antimicrotubule Agent Active Against Drug-Resistant Cells. In: Cancer Res. 1994, 54, S. 3779–3784.
- ↑ M. Kobayashi, M. Kurosu, N. Ohyabu, W. Wang, I. Kitagawa: The Absolute Stereostructure of Arenastatin A, a Potent Cytotoxic Depsipeptide from the Okinawan Marine Sponge Dysidea arenaria. In: Chem. Pharm. Bull. 1994, 42, S. 2196–2198.
- ↑ D. Panda, R. H. Himes, R. E. Moore, L. Wilson, M. A. Jordan: Mechanism of Action of the Unusually Potent Microtubule Inhibitor Cryptophycin 1. In: Biochemistry 1997. 36, S. 12948–12953.
- ↑ D. Panda, K. DeLuca, D. Williams, M. A. Jordan, L. Wilson: Antiproliferative Mechanism of Action of Cryptophycin-52: Kinetic Stabilization of Microtubule Dynamics by High-Affnity Binding to Microtubule Ends. In: Proc. Natl. Acad. Sci. 1998, 95, S. 9313–9318.
- ↑ S. L. Mooberry, L. Busquets, G. Tien: Induction of Apoptosis by Cryptophycin 1. In: A New Antimicrotubule Agent, Int. J. Cancer. 1997, 73, S. 440–448.
- ↑ L. Drew, R. L. Fine, T. N. Do, G. P. Douglas, D. P. Petrylak: The Novel Antimicrotubule Agent Cryptophycin 52 (LY355703) Induces Apoptosis Via Multiple Pathways in Human Prostate Cancer Cells. In: Clin. Canc. Res. 2002. 8, S. 3922–3932.
- ↑ P. Barbier, C. Gregoire, F. Devred, M. Sarrazin, V. Peyrot: In Vitro Effect of Cryptophycin 52 on Microtubule Assembly and Tubulin: Molecular Modeling of the Mechanism of Action of a New Antimitotic Drug. In: Biochemistry 2001. 40, S. 13510–13519.
- ↑ C. Weiß, T. Bogner, B. Sammet, N. Sewald: Total synthesis and biological evaluation of fluorinated cryptophycins. In: Beilstein J Org Chem. (2012), Band 8, S. 2060–2066. doi:10.3762/bjoc.8.231. PMID 23209540; PMC 3511040 (freier Volltext).
- ↑ K. L. Bolduc, S. D. Larsen, D. H. Sherman: Efficient, divergent synthesis of cryptophycin unit A analogues. In: Chem Commun (Camb). (2012), PMID 22617820; PMC 3494784 (freier Volltext).
- ↑ S. Eißler, A. Stoncius, M. Nahrwold, N. Sewald: The Synthesis of Cryptophycins. In: Synthesis. 2006, S. 3747–3789.
- ↑ N. A. Magarvey, Z. Q. Beck, T. Golakoti, Y. Ding, U. Huber, T. K. Hemscheidt, D. Abelson, R. E. Moore, D. H. Sherman: Biosynthetic Characterization and Chemoenzymatic Assembly of Cryptophycins. Potent Anticancer Agents from Nostoc Cyanobionts. In: ACS Chem. Biol. 2006, 1, S. 766–779.
- ↑ Y. Ding, C. M. Rath, K. L. Bolduc, K. Håkansson, D. H. Sherman: Chemoenzymatic synthesis of cryptophycin anticancer agents by an ester bond-forming non-ribosomal peptide synthetase module. In: J Am Chem Soc. (2011), Band 133, Nr. 37, S. 14492–14495. doi:10.1021/ja204716f. PMID 21823639; PMC 3174474 (freier Volltext).
- ↑ J. P. Stevenson, W. Sun, M. Gallagher, R. Johnson, D. Vaughn, L. Schuchter, K. Algazy, S. Hahn, N. Enas, D. Ellis, D. Thornton, P. J. O’Dwyer: Phase I Trial of the Cryptophycin Analogue LY355703 Administered as an Intravenous Infusion on a Day 1 and 8 Schedule Every 21 Days. In: Clin. Canc. Res. 2002, 8, S. 2524–2529.