Cyclopentanon
Cyclopentanon ist ein von Cyclopentan abgeleitetes, cyclisches Keton (Cycloalkanon). Die Verbindung ist als Baustein in natürlichen Verbindungen zu finden, etwa den Thujonen und einigen Prostaglandinen, aber auch in synthetischen pharmazeutischer Produkten, wie Alprostadil und Misoprostol.
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
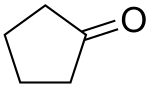
| |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Cyclopentanon | ||||||||||||||||||
| Andere Namen | |||||||||||||||||||
| Summenformel | C5H8O | ||||||||||||||||||
| Kurzbeschreibung |
farblose Flüssigkeit mit schwachem pfefferminzartigem Geruch[2] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 84,12 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
flüssig | ||||||||||||||||||
| Dichte |
0,95 g·cm−3 (20 °C)[2] | ||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Siedepunkt |
131 °C[2] | ||||||||||||||||||
| Dampfdruck | |||||||||||||||||||
| Löslichkeit | |||||||||||||||||||
| Brechungsindex |
1,4366 (20 °C)[4] | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Thermodynamische Eigenschaften | |||||||||||||||||||
| ΔHf0 |
−235,9 kJ/mol (l) | ||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). Brechungsindex: Na-D-Linie, 20 °C | |||||||||||||||||||
Herstellung
BearbeitenCyclopentanon kann durch Erhitzen von Salzen der Adipinsäure oder der Säure selbst synthetisch hergestellt werden.[3]
Weitere Synthesewege sind die katalytische Oxidation von Cyclopenten mit Sauerstoff[7] und die Oxidation von Cyclopentan.[8]
Eigenschaften
BearbeitenPhysikalische Eigenschaften
BearbeitenDie Mischbarkeit mit Wasser ist begrenzt. Mit steigender Temperatur sinkt die Löslichkeit von Cyclopentanon in Wasser bzw. steigt die Löslichkeit von Wasser in Cyclopentanon.[9]
Löslichkeiten zwischen Cyclopentanon und Wasser[9] Temperatur °C 0 10,0 20,1 30,0 40,2 50,0 60,6 70,5 80,0 90,7 Cyclopentanon in Wasser % (m/m) 37,7 34,4 31,0 27,9 25,7 24,4 23,6 23,7 24,8 26,1 Wasser in Cyclopentanon % (m/m) 13,0 13,8 14,4 15,0 15,7 16,9 18,3 20,3 22,4 26,5
Sicherheitstechnische Kenngrößen
BearbeitenCyclopentanon bildet leicht entzündliche Dampf-Luft-Gemische. Die Verbindung hat einen Flammpunkt von 26 °C.[2][10] Der Explosionsbereich liegt zwischen 1,6 Vol.‑% als untere Explosionsgrenze (UEG) und 10,8 Vol.‑% als obere Explosionsgrenze (OEG).[2] Die Sauerstoffgrenzkonzentration wurde mit 8,2 Mol.–% unter Stickstoff und 11,1 Mol.–% unter Kohlendioxid als Inertgas bestimmt.[11] Die Zündtemperatur beträgt 445 °C.[2] Der Stoff fällt somit in die Temperaturklasse T2.
Verwendung
BearbeitenIn der Mikroelektronik wird Cyclopentanon als Lösungsmittel für Fotolacke und Polyimide verwendet.[12][13]
Einzelnachweise
Bearbeiten- ↑ Eintrag zu CYCLOPENTANONE in der CosIng-Datenbank der EU-Kommission, abgerufen am 18. September 2021.
- ↑ a b c d e f g h i j k l m n Eintrag zu Cyclopentanon in der GESTIS-Stoffdatenbank des IFA, abgerufen am 14. Oktober 2019. (JavaScript erforderlich)
- ↑ a b Eintrag zu Cyclopentanon. In: Römpp Online. Georg Thieme Verlag, abgerufen am 12. November 2014.
- ↑ David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press / Taylor and Francis, Boca Raton FL, Physical Constants of Organic Compounds, S. 3-130.
- ↑ Eintrag zu Cyclopentanone im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 1. Februar 2016. Hersteller bzw. Inverkehrbringer können die harmonisierte Einstufung und Kennzeichnung erweitern.
- ↑ David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 95. Auflage. (Internet-Version: 2015), CRC Press / Taylor and Francis, Boca Raton FL, Standard Thermodynamic Properties of Chemical Substances, S. 5-28.
Siehe auch Eintrag zu Cyclopentanon. In: P. J. Linstrom, W. G. Mallard (Hrsg.): NIST Chemistry WebBook, NIST Standard Reference Database Number 69. National Institute of Standards and Technology, Gaithersburg MD, abgerufen am 22. März 2010.. - ↑ J. Smidt, W. Hafner, R. Jira, J. Sedlmeier, R. Sieber, R. Rüttinger, H. Kojer: Katalytische Umsetzungen von Olefinen an Platinmetall-Verbindungen Das Consortium-Verfahren zur Herstellung von Acetaldehyd, in: Angew. Chem. 1959, 71, 176–182; doi:10.1002/ange.19590710503.
- ↑ Patent US2391740: Sensitization of hydrogen bromide catalyzed oxidation reactions. Angemeldet am 17. Januar 1944, veröffentlicht am 25. Dezember 1945, Anmelder: Shell Devel. Co., Erfinder: John H. Raley, Frederick F. Rust.
- ↑ a b R. M. Stephenson: Mutual Solubilities: Water-Ketones, Water-Ethers, and Water-Gasoline-Alcohols in J. Chem. Eng. Data 37 (1992) 80–95, doi:10.1021/je00005a024.
- ↑ E. Brandes, W. Möller: Sicherheitstechnische Kenngrößen. Band 1: Brennbare Flüssigkeiten und Gase. Wirtschaftsverlag NW – Verlag für neue Wissenschaft, Bremerhaven 2003.
- ↑ S. Zakel, J. Förster, M. Mitu: Abschlussbericht zum PTB-Forschungsvorhaben 37064 Sauerstoffgrenzkonzentration von Alkoholen und Ketonen in Stickstoff und Kohlendioxid, PTB Braunschweig, Mai 2023 pdf.
- ↑ Marc J. Madou: Manufacturing Techniques for Microfabrication and Nanotechnology. CRC Press, 2011, ISBN 978-1-4398-9530-6, S. 34 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ Joachim Bargon: Methods and Materials in Microelectronic Technology. Springer Science & Business Media, 2013, ISBN 978-1-4684-4847-4, S. 204 (eingeschränkte Vorschau in der Google-Buchsuche).

