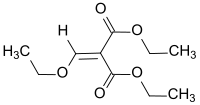
Diethylethoxymethylenmalonat
Diethylethoxymethylenmalonat (DEEMM) ist ein Enolether, der durch Claisen-Kondensation von Malonsäurediethylester mit Orthoameisensäuretriethylester in Gegenwart saurer Katalysatoren entsteht.[6] Die Verbindung ist ein wichtiger Ausgangsstoff[7] für polyfunktionelle Molekülbausteine, wie z. B. zur Darstellung des Monomers Diethylmethylenmalonat,[8] insbesondere aber von therapeutisch relevanten Chinolinderivaten durch die Gould-Jacobs-Reaktion.[9] Ferner dient DEEMM zur Derivatisierung von Aminosäuren und Aminoglykosiden.[10]
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Diethylethoxymethylenmalonat | ||||||||||||||||||
| Andere Namen |
| ||||||||||||||||||
| Summenformel | C10H16O5 | ||||||||||||||||||
| Kurzbeschreibung |
klare, farblose Flüssigkeit[1] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 216,23 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
flüssig[1] | ||||||||||||||||||
| Dichte | |||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Siedepunkt | |||||||||||||||||||
| Löslichkeit |
praktisch unlöslich in Wasser, löslich in Ethanol und Diethylether, wenig löslich in Chloroform[5] | ||||||||||||||||||
| Brechungsindex | |||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Toxikologische Daten | |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). Brechungsindex: Na-D-Linie, 20 °C | |||||||||||||||||||
Vorkommen und Darstellung
BearbeitenDie Darstellung von Diethylethoxymethylenmalonat wurde 1893 von Ludwig Claisen beschrieben, der Diethylmalonat mit Triethylorthoformiat in Gegenwart von Acetanhydrid und Zinkchlorid ZnCl2 durch mehrstündiges Erhitzen zur Reaktion brachte.[6][11]
Formal verläuft die Reaktion unter Abspaltung von 2 Mol Ethanol, der von Acetanhydrid abgefangen wird. Jedoch erfolgt zunächst die Umsetzung von Triethylorthoformiat mit (überschüssigem) Acetanhydrid zu Essigsäurediethoxymethylester (Diethoxymethylacetat, (A))[12], der mit Diethylmalonat unter Bildung von Diethyldiethoxymethylmalonat (B) reagiert, das anschließend unter Abspaltung von Ethanol das Produkt Diethylethoxymethylenmalonat (C) liefert.[13][2]
Die (moderate) Ausbeute an reinem Endprodukt (C) hängt stark von der vollständigen Pyrolyse der Zwischenstufe (B) bei T> 140 °C und der Vermeidung der Bildung fester Kondensationsprodukte bei der Reindestillation ab.
In einem im Jahre 1989 angemeldeten Patent wird die Bildung von DEEMM in einer Prozessvariante unter Verwendung eines säureaktivierten Montmorillonit-Katalysators mit fast quantitativer Ausbeute (95,1 %) beschrieben.[14]
Eigenschaften
BearbeitenDiethylethoxymethylenmalonat ist eine klare und farblose bis schwach gelbliche Flüssigkeit[3], die sich in Wasser praktisch nicht löst, aber in Ethanol und Diethylether löslich ist. DEEMM kann durch fraktionierte Vakuumdestillation gereinigt werden.
Anwendungen
BearbeitenDas reaktive Monomer Diethylmethylenmalonat (3377-20-6)[15] wird bei katalytischer Hydrierung von DEEMM und anschließender Pyrolyse bei ca. 200 °C unter Abspaltung von Ethanol in Rohausbeuten bis 94 % erhalten.[16]
Das strukturell einfache, aber nur mit unbefriedigenden Ausbeuten (4 bis 17 %) zugängliche Polyol Trimethylolmethan[17][18] kann nach einer neueren Patentschrift[19] aus DEEMM in Ausbeuten von ca. 65 % erhalten werden.
In einer Eintopfreaktion in Wasser ohne Katalysatorzusatz entsteht in guter Ausbeute durch Cyclotrimerisierung einer Aldehydzwischenstufe der Triethylester der Trimesinsäure und daraus durch Hydrolyse die freie Säure.[20]
An die elektronenarme Doppelbindung des Diethylethoxymethylenmalonats lassen sich leicht Nukleophile, wie z. B. Alkohole, Phenole, Thiole, Amine usw. addieren. Die nukleophile Addition von Aminen lässt sich für die Derivatisierung von Aminosäuren für HPLC[21] oder zur Einführung der Methylenmalonatfunktion als reversible Schutzgruppe nutzen.[22]
In ähnlicher Weise kann die Aminogruppe von Aminoglycosiden mit DEEMM vor der O-Acylierung geschützt und mit Chlor Cl2 in Chloroform CHCl3 entschützt werden.[23]
Das wichtigste Anwendungsgebiet für Diethylethoxymethylenmalonat ist die Gould-Jacobs-Reaktion, bei der in drei Prozessschritten (Addition-Eliminierung-Cyclisierung) substituierte Chinoline, sowie verwandte N-Heterocyclen gebildet werden können.[10][24] Eine Schlüsselverbindung ist das in hoher Ausbeute zugängliche 7-Chlor-4-hydroxychinolin.[25]
Größere Bedeutung haben insbesondere die von Nalidixinsäure abgeleiteten Chinolon-Antibiotika und die daraus entwickelten Fluorchinolone[26], sowie die in der Malariatherapie eingesetzten Wirkstoffe vom Typ des Chloroquins – aus 7-Chlor-4-hydroxychinolin und 2-Amino-5-diaminopentan (Novoldiamine[27]).[28]
Einzelnachweise
Bearbeiten- ↑ a b c d e f g Eintrag zu Diethylethoxymethylenmalonat in der GESTIS-Stoffdatenbank des IFA, abgerufen am 30. Januar 2022. (JavaScript erforderlich)
- ↑ a b c W.E. Parham, L.J. Reed: Ethyl ethoxymethylenemalonate In: Organic Syntheses. 28, 1948, S. 60, doi:10.15227/orgsyn.028.0060; Coll. Vol. 3, 1955, S. 395 (PDF).
- ↑ a b c Eintrag zu Diethyl Ethoxymethylenemalonate bei TCI Europe, abgerufen am 30. Januar 2022.
- ↑ Datenblatt Ethoxymethylenmalonsäure-diester bei Sigma-Aldrich, abgerufen am 30. Januar 2022 (PDF).
- ↑ a b William M. Haynes: CRC Handbook of Chemistry and Physics, 97th Edition. CRC Press, Boca Raton, FL, U.S.A. 2016, ISBN 978-1-4987-5429-3, S. 3–176.
- ↑ a b L. Claisen: Ueber die Oxymethylenderivate des Acetessigäthers, des Acetylacetons und des Malonsäureäthers. In: Ber. Dtsch. Chem. Ges. Band 26, Nr. 3, 1893, S. 2729–2735, doi:10.1002/cber.18930260375.
- ↑ R.K.F. Marra: Synthetic applications of diethyl ethoxymethylenemalonate. In: Synlett. Band 17, 2010, S. 2679–2680, doi:10.1055/s-0030-1258588.
- ↑ J.-L. De Keyser, T. Altamore: Diethyl Methylenemalonate. In: e-EROS Encyclopedia of Reagents for Organic Synthesis. 2010, doi:10.1002/047084289X.rd201.pub2.
- ↑ R.G. Gould, W.A. Jacobs: The synthesis of certain substituted quinolines and 5,6-benzoquinolines. In: J. Amer. Chem. Soc. Band 61, Nr. 10, 1939, S. 2890–2895, doi:10.1021/ja1265a088.
- ↑ a b L.F. Tietze, H. Geissler, C.W. Downey: Diethyl Ethoxymethylenemalonate. In: e-EROS Encyclopedia of Reagents for Organic Synthesis. 2013, doi:10.1002/047084289X.rd194.pub2.
- ↑ L. Claisen: Untersuchungen über die Oxymethylenverbindungen. (Zweite Abhandlung.). In: Liebigs Ann. Chem. Band 297, Nr. 1–2, 1897, S. 1–98, doi:10.1002/jlac.18972970102.
- ↑ Externe Identifikatoren von bzw. Datenbank-Links zu Diethoxymethyl acetate: CAS-Nr.: 14036-06-7, EG-Nr.: 237-873-4, ECHA-InfoCard: 100.034.417, PubChem: 84166, Wikidata: Q72468927.
- ↑ R.C. Fuson, W.E. Parham, L.J. Reed: Alkylation of ethyl malonate with diethoxymethyl acetate. In: J. Org. Chem. Band 11, Nr. 2, 1946, S. 194–198, doi:10.1021/jo01172a014.
- ↑ Patent DE3927761C2: Verfahren zur Herstellung von Alkoxyalkylidenmalonsäureestern. Angemeldet am 23. August 1989, veröffentlicht am 27. November 1997, Anmelder: Huels Chemische Werke AG, Erfinder: Franz-Albert von Itter, Klaus-Dieter Steffen.
- ↑ ChemilianTM M1000 XP. In: Technical Datasheet. Sirrus Chemistry, 18. Juni 2020, archiviert vom (nicht mehr online verfügbar) am 19. September 2020; abgerufen am 12. Januar 2022.
- ↑ W. Feely, V. Boekelheide: Diethyl methylenemalonate In: Organic Syntheses. 38, 1958, S. 22, doi:10.15227/orgsyn.038.0022; Coll. Vol. 4, 1963, S. 298 (PDF).
- ↑ Externe Identifikatoren von bzw. Datenbank-Links zu trimethylolmethane: CAS-Nr.: 4704-94-3, EG-Nr.: 225-187-8, ECHA-InfoCard: 100.022.897, PubChem: 78432, ChemSpider: 70801, Wikidata: Q27268075.
- ↑ F.L. Breusch, M. Oguzer: Darstellung der di-,tri- und tetra-homologen Reihen der Methan-methylol-fettsäureester (XIV. Mitteil.1) über isomere und homologe Reihen). In: Chem. Ber. Band 88, Nr. 10, 1955, S. 1511–1519, doi:10.1002/cer.19550881007.
- ↑ Patent US4091040A: Procedure for making trimethylolmethane. Angemeldet am 21. Juli 1977, veröffentlicht am 23. Mai 1978, Anmelder: The United States of America by the Secretary of the Navy, Washington, D.C., Erfinder: A.T. Nielsen.
- ↑ D. I. Bazhin, Y.S. Kudyakova, Y.V. Burgart, V.I. Saloutin: Catalyst-free transformations of diethyl 2-ethoxymethylenemalonate and diethyl polyfluorobenzoylmalonates in water. In: Tetrahedron Lett. Band 53, Nr. 15, 2012, S. 1961–1963, doi:10.1016/j.tetlet.2012.02.01.
- ↑ M. Alaiz, J. Girón, F.J. Hidalgo, M.P. de la Maza, F. Millán, R. Zamora, E. Vioque: Esterification of amino acids as their 2,2-bis(ethoxycarbonyl)vinyl derivatives. In: Synthesis. Band 7, 1987, S. 544–547, doi:10.1055/s-1989-27312.
- ↑ A. Ilangovan, R.G. Kumar: 2,2-Bis(ethoxycarbonyl)vinyl (BECV) as a versatile amine protecting group for selective functional-group transformations. In: Chem. Eur. J. Band 16, Nr. 9, 2010, S. 2938–2943, doi:10.1002/chem.200902054.
- ↑ C.O. Mellet, J.L. Jiménez Bianco, J.M. Garcia Fernández, J. Fuente: O-Acetyl protection of 6-aminoaldopyranosides and 1-aminoalditols. In: J. Carbohydr. Chem. Band 14, Nr. 8, 1995, S. 1133–1152, doi:10.1080/07328309598005400.
- ↑ C.C. Price, R.M. Roberts: The synthesis of 4-hydroxyquinolines. I. Through ethoxymethylenemalonic ester. In: J. Amer. Chem. Soc. Band 68, Nr. 7, 1946, S. 1204–1208, doi:10.1021/ja01211a020.
- ↑ Externe Identifikatoren von bzw. Datenbank-Links zu 7-chloroquinolin-4-ol: CAS-Nr.: 86-99-7, EG-Nr.: 201-715-2, ECHA-InfoCard: 100.001.560, PubChem: 66593, ChemSpider: 59961, Wikidata: Q27463509.
- ↑ L.A. Mitscher: Bacterial topoisomerase inhibitors: Quinolone and pyridone antibacterial agents. In: Chem. Rev. Band 105, Nr. 2, 2005, S. 559–592, doi:10.1021/cr030101q.
- ↑ Externe Identifikatoren von bzw. Datenbank-Links zu novoldiamine: CAS-Nr.: 140-80-7, EG-Nr.: 205-435-1, ECHA-InfoCard: 100.004.942, GESTIS: 491295, PubChem: 78953, ChemSpider: 71286, Wikidata: Q27274759.
- ↑ 4,7-Dichloroquinoline In: Organic Syntheses. 28, 1948, S. 38, doi:10.15227/orgsyn.028.0038; Coll. Vol. 3, 1955, S. 272 (PDF).

