Isomere des Piperins
Isomere des Piperins sind das Isopiperin, das Chavicin und das Isochavicin. Sie unterscheiden sich durch die Doppelbindungskonfiguration vom Piperin, das die Konfiguration (E,E) hat. Beim Isopiperin ist die Konfiguration (Z,E), beim Chavicin (Z,Z) und beim Isochavicin (E,Z).

| Isomere des Piperins | ||||
| Name | Isopiperin | Chavicin | Isochavicin | |
| Strukturformel | 
|
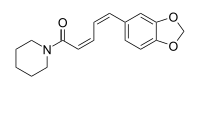
|

| |
| CAS-Nummer | 30511-76-3 | 495-91-0 | 30511-77-4 | |
| Konfiguration | (Z,E) | (Z,Z) | (E,Z) | |
| PubChem | 1548913 | 1548912 | 1548914 | |
| ChemSpider | 1265936 | |||
| Wikidata | ||||
| Summenformel | C17H19NO3 | |||
| Molare Masse | 285,34 g·mol−1 | |||
| GHS- Kennzeichnung |
| |||
| H- und P-Sätze | siehe oben | |||
| siehe oben | ||||
| siehe oben | ||||
Vorkommen
BearbeitenDie Isomere des Piperins kommen wie das Piperin selbst in Piper nigrum vor, allerdings in deutlich geringeren Mengen von etwa 0,37–0,42 % (Isochavicin), 0,15–0,23 % (Isopiperin) und 0,01–007 % (Chavicin).[1] Außerdem wurden sie in Piper ribesoides nachgewiesen.[2] Isochavicin kommt auch in Piper retrofractum vor.[3]
Entstehung
BearbeitenDie Isomere des Piperins entstehen aus diesem durch Lichteinwirkung oder enzymatische Reaktionen.[1] Bei der Photoisomerisierung entsteht bevorzugt Isochavicin.[4]
Synthese
BearbeitenIsochavicin kann ausgehend von Piperonal synthetisiert werden. Dieses wird zunächst in einen Propargylalkohol überführt. Dieser wird mit N-Acetylpiperidin-Diethylacetal zu einem Allen umgesetzt. Isomerisierung mit Aluminiumoxid führt zum Isochavicin.[5]
Eigenschaften
BearbeitenIm Gegensatz zu Piperin schmecken die drei Isomere wenig bis gar nicht scharf, sodass die Isomerisierung zu einem Schärfeverlust führt.[1][4] Isopiperin und Isochavicin binden aber ebenso wie Piperin an den Vanilloid-Rezeptor.[6] In einer Studie an Mäusen zeigte Chavicin einen gedächtnisverbessernden Effekt.[7]
Nachweis
BearbeitenDie verschiedenen Isomere des Piperins (inklusive Piperin selbst) können durch eine Kombination aus 1H-NMR und HPLC mit UV-Detektor nachgewiesen und unterschieden werden.[8]
Einzelnachweise
Bearbeiten- ↑ a b c Nobuyuki Kozukue, Mal-Sun Park, Suk-Hyun Choi, Seung-Un Lee, Mayumi Ohnishi-Kameyama, Carol E. Levin, Mendel Friedman: Kinetics of Light-Induced Cis−Trans Isomerization of Four Piperines and Their Levels in Ground Black Peppers as Determined by HPLC and LC/MS. In: Journal of Agricultural and Food Chemistry. Band 55, Nr. 17, 1. August 2007, S. 7131–7139, doi:10.1021/jf070831p.
- ↑ Takashi Kitayama, Kanako Yasuda, Takeharu Kihara, Michiho Ito, Hiromi Fukumoto, Masanori Morimoto: Piperine analogs in a hydrophobic fraction from Piper ribersoides (Piperaceae) and its insect antifeedant activity. In: Applied Entomology and Zoology. Band 48, Nr. 4, November 2013, S. 455–459, doi:10.1007/s13355-013-0204-4.
- ↑ Prapaipit Suwitchayanon, Osamu Ohno, Kiyotake Suenaga, Hisashi Kato-Noguchi: Phytotoxic property of Piper retrofractum fruit extracts and compounds against the germination and seedling growth of weeds. In: Acta Physiologiae Plantarum. Band 41, Nr. 3, März 2019, doi:10.1007/s11738-019-2824-y.
- ↑ a b R. De Cleyn, M. Verzele: Constituents of peppers: I. Qualitative analysis of piperine isomers. In: Chromatographia. Band 5, Nr. 6, Juni 1972, S. 346–350, doi:10.1007/BF02315254.
- ↑ Sadao Tsuboi, Yuji Nooda, Akira Takeda: A facile synthesis of 3,4-dienamides by the reaction of propargyl alcohols with cyclic amide acetals, and their stereoselective rearrangement to 2(E),4(Z)-dienamides promoted with alumina. Total synthesis of isochavicine. In: The Journal of Organic Chemistry. Band 49, Nr. 7, April 1984, S. 1204–1208, doi:10.1021/jo00181a012.
- ↑ Yukiko Okumura, Masataka Narukawa, Yusaku Iwasaki, Aiko Ishikawa, Hisashi Matsuda, Masayuki Yoshikawa, Tatsuo Watanabe: Activation of TRPV1 and TRPA1 by Black Pepper Components. In: Bioscience, Biotechnology, and Biochemistry. Band 74, Nr. 5, 23. Mai 2010, S. 1068–1072, doi:10.1271/bbb.90964.
- ↑ Ghazala Iqbal, Anila Iqbal, Aamra Mahboob, Syeda M. Farhat, Touqeer Ahmed: Memory Enhancing Effect of Black Pepper in the AlCl3 Induced Neurotoxicity Mouse Model is Mediated Through Its Active Component Chavicine. In: Current Pharmaceutical Biotechnology. Band 17, Nr. 11, 2. September 2016, S. 962–973, doi:10.2174/1389201017666160709202124.
- ↑ Toshiyuki Mizumoto, Fusako Nakano, Yuzo Nishizaki, Naoko Masumoto, Naoki Sugimoto: Quantitative Analysis of Piperine and the Derivatives in Long Pepper Extract by HPLC Using Relative Molar Sensitivity. In: Food Hygiene and Safety Science (Shokuhin Eiseigaku Zasshi). Band 60, Nr. 5, 25. Oktober 2019, S. 134–143, doi:10.3358/shokueishi.60.134.