Isoprenregel
| Kopf- und Schwanzposition beim Isopren |
|---|
 Isopren |
| Isopren enthält 5 Kohlenstoffatome |
|---|
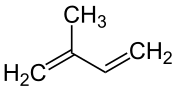 Isopren |
| Monoterpene enthalten 10 Kohlenstoffatome |
|---|
 Myrcen, die rot markierte Schlangenlinie markiert die Verknüpfungsstelle zwischen den beiden Isopren-Einheiten |
 Limonen, die rot markierten Schlangenlinien markieren die Verknüpfungsstellen zwischen den beiden Isopren-Einheiten |
| Sesquiterpene enthalten 15 Kohlenstoffatome |
|---|
 Candinen, die rot markierten Schlangenlinien markieren die Verknüpfungsstellen zwischen den drei Isopren-Einheiten |
Die Isoprenregel erkannte zuerst der deutsche Chemiker Otto Wallach[1]. Erstmals formulierte sie der kroatische Chemiker Leopold Ružička, sie ist eine empirische Regel in der Naturstoffchemie.[2] Demnach sind viele Naturstoffe Oligomere oder Polymere[3] des Isoprens (2-Methyl-1,3-butadien, Summenformel: C5H8).
Monoterpene (C10) aus zwei Isopreneinheiten – mit je fünf Kohlenstoffatomen (C5) – sowie Sesquiterpene (C15) aus drei Isopreneinheiten sind einfache Beispiele für solche Naturstoffe. Diterpene (C20) aus vier Isopreneinheiten und Carotinoide (C40) aus acht Isopreneinheiten sind komplexere Beispiele. Dolichol (C100) enthält folglich 20 Isopreneinheiten. Kautschuk ist ein Polyterpen der Summenformel (C5H8)n mit n = 8000–30000[4] und kann pyrolytisch zu Isopren abgebaut werden.
Die Entdeckung von nicht der Isoprenregel gehorchenden Naturstoffen – wie beispielsweise Lanosterin – führte 1953 zu einer Neuformulierung durch Leopold Ružička, zur biogenetischen Isoprenregel.[5] Demnach sind die scheinbaren Ausnahmen von der Isoprenregel begründet in Folgereaktionen (Isomerisierungen, Alkylierungen, Desalkylierungen).[6] Weiterhin wurde erkannt, dass die Oligomerisierung des Isoprens neben der üblichen Kopf-Schwanz-Verknüpfung auch über die Kopf-Kopf- oder Schwanz-Schwanz-Verknüpfung realisiert werden kann.[2]
Chemiehistorische Bedeutung
BearbeitenChemiehistorisch besitzt die Isoprenregel eine erhebliche Bedeutung, da die Konstitutionsermittlung zahlreicher Naturstoffe so erst möglich war.
Einzelnachweise
Bearbeiten- ↑ Albert Gossauer: Struktur und Reaktivität der Biomoleküle, Verlag Helvetica Chimica Acta, Zürich, 2006, S. 124–133, ISBN 978-3-906390-29-1.
- ↑ a b Otto-Albrecht Neumüller (Hrsg.): Römpps Chemie-Lexikon. Band 3: H–L. 8. neubearbeitete und erweiterte Auflage. Franckh’sche Verlagshandlung, Stuttgart 1983, ISBN 3-440-04513-7, S. 1966.
- ↑ Hans Beyer und Wolfgang Walter: Organische Chemie, S. Hirzel Verlag, Stuttgart, 1984, S. 627, ISBN 3-7776-0406-2.
- ↑ Otto-Albrecht Neumüller (Hrsg.): Römpps Chemie-Lexikon. Band 3: H–L. 8. neubearbeitete und erweiterte Auflage. Franckh’sche Verlagshandlung, Stuttgart 1983, ISBN 3-440-04513-7, S. 2064–2069.
- ↑ Leopold Ruzika: Rolle der Riechstoffe in meinem chemischen Lebenswerk, Helv. Chim. Acta 54 (1971) 1753–1759.
- ↑ J. W. Cornforth: Olefin-Alkylierung in der Biosynthese, Angew. Chem. 80 (1968) S. 977–985, DOI: 10.1002/ange.19680802302.