Kupfer(II)-citrat
Kupfer(II)-citrat ist das Kupfersalz der Citronensäure.
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
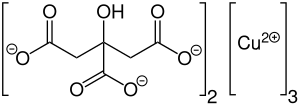
| |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Kupfer(II)-citrat | ||||||||||||||||||
| Andere Namen |
| ||||||||||||||||||
| Summenformel | C12H10Cu3O14 | ||||||||||||||||||
| Kurzbeschreibung |
hellblauer Feststoff[1] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 568,84 g·mol−1 (wasserfrei) | ||||||||||||||||||
| Aggregatzustand |
fest | ||||||||||||||||||
| Löslichkeit |
schwer löslich in Wasser[2] | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Toxikologische Daten | |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | |||||||||||||||||||
Beschreibung
BearbeitenKupfer(II)-citrat ist ein kristalliner geruchloser Feststoff, mit einer für Kupferverbindungen charakteristischen blauen Farbe. Es ist in Wasser schwer löslich.[2]
Herstellung
BearbeitenKupfer(II)-citrat lässt sich beispielsweise durch Reaktion von Kupfer(II)-hydroxid (Cu(OH)2) mit Citronensäure herstellen:
Alternativ kann man Kupfer(II)-citrat auch durch die elektrochemische Umsetzung von mit Wasser verdünnter Citronensäure und Kupfer gewinnen.
Verwendung
BearbeitenKupfer(II)-citrat wird in der Önologie zur Behandlung des Weinfehlers „Böckser“ – ein Geruchs- und Aromafehler – verwendet. Kupfercitrat wird dabei als granuliertes „Kupzit“ (mit 5 % Gehalt an Kupfercitrat) dem Wein zugegeben. Dies führt allerdings dazu, dass dann freie, geschmacklich völlig unzulängliche, Kupferionen im Wein verbleiben. Diese müssen daher nach der Böckser-Behandlung mit Kaliumhexacyanidoferrat(II) abgefangen werden, welches die freien Kupferionen weitgehend in eine unlösliche und somit vom Wein abfiltrierbare Form überführt.[5]
Daneben wird Kupfercitrat noch als Algizid in Schwimmbädern, als Antiseptikum, in Metallbearbeitungsölen[1] sowie schon seit 1849 als Pigment[6] verwendet. In geringem Umfang wird das Citrat zur Holzkonservierung eingesetzt.[7] Auch in Nahrungsergänzungsmitteln ist es für das Spurenelement Kupfer als Komponente enthalten.
Sicherheitshinweise
BearbeitenBei Hamstern zeigte Kupfer(II)-citrat nach einer Gabe an trächtige Tiere eine fruchtschädigende Wirkung, vorwiegend Missbildungen des cardiovaskulären Systems.[8][9] Die akute letale Dosis bei Ratten beträgt bei oraler Aufnahme 1.580 mg·kg−1.[4]
Literatur
Bearbeiten- A. J. Davison, R. T. Hamilton: Stimulation of cytochrome c oxidation by a copper citrate complex. In: Arch. Biochem. Biophys. Band 126, 1968, S. 228–231; PMID 5671065.
- Abdelaziz Madinzia, Mohammed El Amanea, Hamid Atmani: Synthesis, characterisation and electrochemical properties of the copper citrate complexes. In: Annales de Chimie Science des Materiaux. Band 25, 2000, S. 179–185; doi:10.1016/S0151-9107(00)88893-5.
- F. J. Di Carlo: Syndromes of cardiovascular malformations induced by copper citrate in hamsters. In: Teratology. Band 21, 1980, S. 89–101. PMID 7385058.
Einzelnachweise
Bearbeiten- ↑ a b Kupferchemikalien. ( vom 31. Mai 2015 im Internet Archive) (PDF; 1,1 MB) S. 11.
- ↑ a b Dale L. Perry: Handbook of Inorganic Compounds, Second Edition. Taylor & Francis US, 2011, ISBN 1-4398-1462-7, S. 139 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ Für diesen Stoff liegt noch keine harmonisierte Einstufung vor. Wiedergegeben ist eine von einer Selbsteinstufung durch Inverkehrbringer abgeleitete Kennzeichnung von Disilver oxalate im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 22. Dezember 2024.
- ↑ a b Eintrag zu Cupric citrate in der ChemIDplus-Datenbank der United States National Library of Medicine (NLM) (Seite nicht mehr abrufbar)
- ↑ Siegmar Görtges: Böckserbeseitigung mit Kupfercitrat. In: Der Deutsche Weinbau. Nr. 20, 2. Oktober 2009, S. 24–25 (PDF).
- ↑ N. Eastaugh, V. Walsh, T. Chaplin, R. Siddall: Pigment Compendium: A Dictionary of Historical Pigments. Butterworth-Heinemann, 2004, ISBN 978-0-7506-5749-5.
- ↑ T. G. Townsend, H. M. Solo-Gabriele: Environmental Impacts of Treated Wood. CRC Press, 2006, ISBN 978-0-8493-6495-2.
- ↑ M. J. Derelanko, M. A. Hollinger: Handbook of Toxicology. CRC Press, 2002, ISBN 978-0-8493-0370-8.
- ↑ NRC (USA): Mineral Tolerance of Domestic Animals. National Academy of Sciences, Washington, 1980.