Lysyloxidase
Lysyloxidase, auch als Protein-Lysin-6-Oxidase bezeichnet, ist ein Enzym, das vorwiegend im extrazellulären Raum des Bindegewebes der Wirbeltiere vorkommt. Es katalysiert die oxidative Desaminierung von Lysinresten und ermöglicht dadurch Quervernetzungen in Kollagen und Elastin, wodurch diese Proteine mechanisch stabilisiert werden. Beim Menschen können Kupfermangel und Mutationen im LOX-Gen zur Verringerung der Enzymaktivität und diese zu Cutis laxa führen.[2]
| Lysyloxidase | ||
|---|---|---|

| ||
| Lysyloxidase homodimer, Komagataella pastoris nach PDB 1n9e | ||
| Eigenschaften des menschlichen Proteins | ||
| Masse/Länge Primärstruktur | 249 Aminosäuren | |
| Kofaktor | Cu++ | |
| Präkursor | Preprolysyloxidase (417 Aminosäuren) | |
| Bezeichner | ||
| Gen-Name | LOX | |
| Externe IDs | ||
| Enzymklassifikation | ||
| EC, Kategorie | 1.4.3.13, Oxidoreduktase | |
| Reaktionsart | Oxidative Desaminierung | |
| Substrat | Peptidyl-Lysin + O2 + H2O | |
| Produkte | Peptidyl-Allysin + H2O2 + NH3 + H+ | |
| Vorkommen | ||
| Homologie-Familie | Hovergen | |
| Übergeordnetes Taxon | Wirbeltiere[1] | |
| Orthologe | ||
| Mensch | Hausmaus | |
| Entrez | 4015 | 16948 |
| Ensembl | ENSG00000113083 | ENSMUSG00000024529 |
| UniProt | P28300 | P28301 |
| Refseq (mRNA) | NM_001178102 | NM_001286181 |
| Refseq (Protein) | NP_001171573 | NP_001273110 |
| Genlocus | Chr 5: 122.06 – 122.08 Mb | Chr 18: 52.52 – 52.53 Mb |
| PubMed-Suche | 4015 | 16948
|
Beschreibung
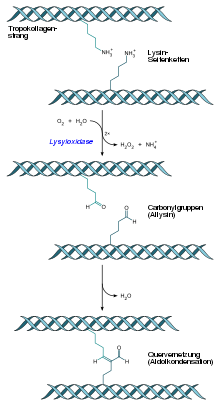
BearbeitenLysyloxidase spielt im extrazellulären Raum eine wichtige Rolle bei der Quervernetzung von Kollagen und Elastin. Hierbei katalysiert es die Synthese von Carbonylgruppen an Lysin- und Hydroxylysinresten in Kollagenen sowie Lysinresten in Elastin. Durch die Bildung von Schiffschen Basen und Aldolkondensationen entstehen in Folge Quervernetzungen. Die Lysyloxidase schafft somit die chemischen Voraussetzungen für die Bildung von Kollagenfibrillen und elastischen Fasern und trägt wesentlich zur enzymatischen Stabilität und Langlebigkeit der Fasernetzwerke bei.
Die Lysyloxidase gehört zur Gruppe der chinonenthaltenden, kupferbasierten Aminoxidasen und die durch sie induzierte Reaktion is abhängig vom Kofaktor Lysyl-Tyrosyl-Chinon (LTQ). Lysyloxidase wird von dem LOX-Gen codiert, das sich beim Menschen auf Chromosom 5 Genlocus q23.3-q31.2 befindet.[3] Das Genprodukt (Pre-Pro-Lysyloxidase) hat unmittelbar nach der Translation intrazellulär eine molare Masse von 47 kDa. Nach der Glykosylierung steigt sie auf 50 kDa an. Nach der Sekretion in den extrazellulären Raum wird die Pre-Pro-Lysyloxidase extrazellulär durch das knochenmorphogenetische Protein 1 in zwei Fragmente gespalten: in die 32 kDa schwere Lysyloxidase und in ein 18 kDa schweres Propeptid.[4]
Einzelnachweise
Bearbeiten- ↑ PROSITE documentation PDOC007176. Swiss Institute of Bioinformatics (SIB), abgerufen am 20. September 2011 (englisch).
- ↑ UniProt P28300
- ↑ HGNC:LOX, abgerufen am 21. Juli 2011.
- ↑ N. Pischon: Bedeutung der extrazellulären Kollagenmodifikationen für die Osteoblastendifferenzierung und Entstehung von Knochengewebe. (PDF-Datei; 311 kB) Habilitationsschrift, Charité - Universitätsmedizin Berlin, 2010, S. 5f.
Weblinks
Bearbeiten- Lysyloxidase. In: Online Mendelian Inheritance in Man. (englisch)