Niob(V)-chlorid
Niob(V)-chlorid ist eine salzartige chemische Verbindung bestehend aus den Elementen Niob und Chlor.
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Niob(V)-chlorid | ||||||||||||||||||
| Andere Namen |
Niobpentachlorid | ||||||||||||||||||
| Summenformel | NbCl5 | ||||||||||||||||||
| Kurzbeschreibung |
gelber Feststoff mit stechendem Geruch[1] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 270,17 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
fest[1] | ||||||||||||||||||
| Dichte |
2,75 g·cm−3[1] | ||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Siedepunkt |
248,2 °C[1] | ||||||||||||||||||
| Löslichkeit |
heftige Zersetzung in Wasser[1] | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | |||||||||||||||||||
Gewinnung und Darstellung
BearbeitenNiob(V)-chlorid kann durch Reaktion von Niob mit Chlor gewonnen werden.[2]
Ebenfalls möglich ist Darstellung durch Reaktion von Niob(V)-oxid mit Thionylchlorid oder Kohlenstofftetrachlorid[2] oder Hexachlorpropen[3]:
Eigenschaften
BearbeitenEs handelt sich um einen gelben Feststoff mit stechendem Geruch (Bildung von Chlorwasserstoff durch Hydrolyse), der sich heftig in Wasser zersetzt.
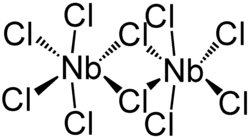
Niob(V)-chlorid bildet eine dimere Struktur aus, bei welcher jedes Niobatom sechsfach durch Chloro-Liganden koordiniert ist. Zwei Chloratome fungieren als Brückenliganden. Es existieren zwei kristalline Polymorphe von Niob(V)-chlorid; in beiden wird eine verzerrt-oktaedrische Struktur ausgebildet, bei der die pseudo-axialen Chloroliganden in einem Winkel von ca. 84 ° zur pseudo-equatorialen Ebene angeordnet sind.[4][5]
Verwendung
BearbeitenNiob(V)-chlorid wird in der organischen Chemie als Lewis-Säure verwendet. So findet es beispielsweise in der Aktivierung von Alkenen in der Carbonyl-En-Reaktion Anwendung.[6]
Einzelnachweise
Bearbeiten- ↑ a b c d e f g h Eintrag zu Niob(V)-chlorid in der GESTIS-Stoffdatenbank des IFA, abgerufen am 20. Januar 2022. (JavaScript erforderlich)
- ↑ a b Georg Brauer (Hrsg.) u. a.: Handbuch der Präparativen Anorganischen Chemie. 3., umgearbeitete Auflage. Band III, Ferdinand Enke, Stuttgart 1981, ISBN 3-432-87823-0, S. 1444.
- ↑ W. W. Porterfield and S. Y. Tyree, Jr.: Anhydrous metal chlorides. In: S. Young Tyree, Jr. (Hrsg.): Inorganic Syntheses. Band 9. McGraw-Hill Book Company, Inc., 1967, S. 133–136 (englisch).
- ↑ W. Hoenle, H. G. v. Schnering: Crystal structure of niobium pentachloride. In: Zeitschrift für Kristallographie, 1990, 191, S. 139–140 (doi:10.1524/zkri.1990.191.1-2.139)
- ↑ F. A. Cotton, P. A. Kibala, M. Matusz, R. B. W. Sandor in: Structure of the Second Polymorph of Niobium Pentachlorid 1997, Acta Crystallographica C47, S. 2435–2437 (doi:10.1107/S0108270191000239).
- ↑ C. K. Z. Andrade, O. E. Vercillo, J. P. Rodrigues, D. P. Silveira in: J. Braz. Chem. Soc. 2004, 15, 6, 813–817.

