Nitrilotriacetonitril
Nitrilotriacetonitril (NTAN) ist ein Vorprodukt für Nitrilotriessigsäure (NTA), einem bioabbaubaren Komplexbildner und Builder für Waschmittel, für Tris(2-aminoethyl)amin,[S 1] einem tripodalen vierzähnigen, unter der Abkürzung tren gebräuchlichen Chelatbildner, sowie für den Epoxidharz-Vernetzer 1-(2-Aminoethyl)piperazin.
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
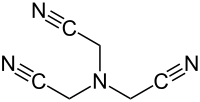
| |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Nitrilotriacetonitril | ||||||||||||||||||
| Andere Namen |
| ||||||||||||||||||
| Summenformel | C6H6N4 | ||||||||||||||||||
| Kurzbeschreibung |
farbloser Feststoff[1] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 134,14 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
fest | ||||||||||||||||||
| Dichte | |||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Löslichkeit |
schwer löslich in Wasser (3 g·l−1 bei 20 °C)[5], löslich in Nitromethan[3] und in Aceton[4] | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | |||||||||||||||||||
Vorkommen und Darstellung
BearbeitenDie Synthese von Nitrilotriacetonitril geht aus von den Grundbausteinen Ammoniak, Formaldehyd und Cyanwasserstoff, die in saurem wässrigem Medium in diskontinuierlichen oder kontinuierlichen Verfahren zur Reaktion – einer dreifachen Cyanmethylierung des Ammoniaks – gebracht werden.[1][3]
Ammoniak wird gasförmig, als Hexamethylentetramin[7] oder in Form von Ammoniumsulfat zusammen mit Formaldehyd als wässrige (in der Regel 37 Gew.%ige) Formalin-Lösung bei pH-Werten < 2 vorgelegt und mit wässriger Blausäure-Lösung oder flüssigem Cyanwasserstoff – gegebenenfalls ohne Vorreinigung direkt aus dem Andrussow-Verfahren oder dem BMA-Verfahren von Evonik Degussa[8] – bei Temperaturen um 100 °C umgesetzt. Bei Rückführung der Mutterlaugen werden Ausbeuten über 90 % erzielt.
Problematisch insbesondere bei kontinuierlicher Verfahrensführung ist die Neigung von NTAN zur Ausfällung bei Temperaturen unter 90 °C, die zur Verstopfung von Rohrreaktoren und -leitungen und thermischem Durchgehen (runaway reaction) der Reaktion führen können.[9]
Eigenschaften
BearbeitenNitrilotriacetonitril ist ein farbloser und geruchloser Feststoff, die sich in Wasser schwer und in Nitromethan und Aceton gut löst.[10]
Anwendungen
BearbeitenNitrilotriacetonitril lässt sich in der Schmelze in Gegenwart basischer Katalysatoren, wie z. B. Natriummethanolat homo- oder mit Iminodiacetonitril zu dunkel gefärbten festen Polymeren copolymerisieren, die sich bei Temperaturen > 1000 °C unter Schutzgas zu stickstoffhaltigen und elektrisch leitfähigen Polymeren carbonisieren lassen.[11] Die erhaltenen Produkte haben keine Anwendung als leitfähige Polymere gefunden.
Die Hydrierung von NTAN überführt zunächst eine Cyanogruppe in eine Iminogruppe, die schneller eine benachbarte und sterisch zur Ausbildung eines sechsgliedrigen Ringssystems geeignete Cyanogruppe angreift, als weiter zur primären Aminogruppe hydriert zu werden. Als Endprodukt der katalytischen Hydrierung von Nitrilotriacetonitril fällt daher 1-(2-Aminoethyl)piperazin an.
Führt man die katalytische Hydrierung von NTAN mit z. B. Raney-Nickel hingegen in Gegenwart eines großen Ammoniaküberschusses durch, erhält man Tris(2-aminoethyl)amin[12],
einen vierzähnigen Komplexbildner (als „tren“ abgekürzt), der besonders mit zwei- und dreiwertigen Übergangsmetallionen stabile Chelate bildet.[13]
Mit Formaldehyd reagiert Nitrilotriacetonitril bei pH 9,5 zum 2,2-Dihydroxymethyl-nitrilotriacetonitril, das mit Natronlauge bei 100 °C zum Trinatriumsalz der 2-Hydroxymethylserin-N,N-diessigsäure hydrolysiert wird, aus dem durch Ansäuern die freie Säure in 51%iger Ausbeute erhalten werden kann.[14]
Die Verbindung eignet sich als Komplexbildner für Schwermetall- oder Erdalkalimetallionen, als Bleichmittel-Stabilisator, z. B. für Natriumperborat, in festen Waschmittelzubereitungen und als Builder in Waschmitteln zur Inhibierung der Bildung von Ablagerungen (Inkrustationen) in Textilien bei der Wäsche.
Die Hydrolyse von Nitrilotriacetonitril mit Wasser in konzentrierter Schwefelsäure liefert unter schonenden Bedingungen praktisch quantitativ Nitrilotriacetamid, das als neutraler vierzähniger Ligand zur Metallkomplexierung untersucht wurde.[15] Bei erhöhter Temperatur entsteht durch Ringschluss 3,5-Dioxopiperazin-1-acetamid, das nach Neutralisation und Erhitzen mit überschüssigem wässrigem Ammoniak wieder quantitativ in das Nitrilotriacetamid überführt werden kann.[16][17]
Nitrilotriacetonitril dient hauptsächlich als Rohstoff für die Herstellung des zwar bioabbaubaren, aber krebsverdächtigen Komplexbildners Nitrilotriessigsäure durch säure-[18] oder basenkatalysierte[1][19] Hydrolyse der Cyanogruppen.
Unerwünschte Restgehalte an Cyanidionen im Hydrolysat können durch Nachbehandlung mit Oxidationsmitteln, wie z. B. Natriumhypochlorit bei pH 8 entfernt werden.[18]
Anmerkungen
BearbeitenEinzelnachweise
Bearbeiten- ↑ a b c d Patent US3337607: Process for preparation of an amine nitrile. Angemeldet am 25. Januar 1965, veröffentlicht am 22. August 1967, Anmelder: Ethyl Corp., Erfinder: J.C. Wollensak.
- ↑ Carl L. Yaws: Thermophysical Properties of Chemicals and Hydrocarbons, 2nd Edition. Elsevier Inc., Oxford, UK 2014, ISBN 978-0-323-28659-6, S. 279.
- ↑ a b c Patent US3840581: Process for the manufacture of nitrilotriacetonitrile. Angemeldet am 26. Mai 1970, veröffentlicht am 8. Oktober 1974, Anmelder: Knapsack AG, Erfinder: H. Neumaier, W. Vogt, K. Sennewald, R. Schuller, G. Lenz.
- ↑ a b M.D. Larranaga, R.J. Lewis, Sr., R.A. Lewis: Hawley’s Condensed Chemical Dictionary, 16th Edition. Wiley, Hoboken, N.J. 2016, ISBN 978-1-118-13515-0, S. 974.
- ↑ Registrierungsdossier zu Nitrilotriacetonitrile (Abschnitt Stability in organic solvents and identity of relevant degradation products) bei der Europäischen Chemikalienagentur (ECHA), abgerufen am 26. Dezember 2017.
- ↑ a b Pfaltz & Bauer: N05890, Nitrilotriacetonitrile, abgerufen am 26. Dezember 2017.
- ↑ Patent US3061628: Process and preparation of amino nitriles and acetic acids. Angemeldet am 12. September 1958, veröffentlicht am 30. Oktober 1962, Anmelder: Hampshire Chemical Corp., Erfinder: J.J. Singer, Jr., M. Weisberg.
- ↑ Patent EP0102343B1: Process for producing nitrilotriacetonitrile. Angemeldet am 25. August 1983, veröffentlicht am 26. Februar 1986, Anmelder: Monsanto Co., Erfinder: C.Y. Shen.
- ↑ E. Fiedler: Emergency Runaway Reaction – What Precedes? What Follows? In: Chem. Engineer. Transactions (CET). Band 48, 2016, ISBN 978-88-95608-39-6, S. 361–366, doi:10.3303/CET1648061.
- ↑ Product Stewardship Summary, Chelates: NTAN. (PDF; 45,7 KB) In: akzonobel.com. Akzo Nobel Functional Chemicals, archiviert vom (nicht mehr online verfügbar) am 2. Juni 2013; abgerufen am 20. März 2017 (englisch).
- ↑ Patent US3578643: New polymers from nitrilotriacetonitrile and iminodiacetonitrile. Angemeldet am 6. Juni 1969, veröffentlicht am 11. Mai 1971, Anmelder: W.R. Grace & Co., Erfinder: L.L. Wood, R.A. Hamilton.
- ↑ Patent US3565957: Hydrogenation of nitrilotriacetonitrile. Angemeldet am 20. September 1968, veröffentlicht am 23. Februar 1971, Anmelder: Stauffer Chemical Co., Erfinder: S.B. Mirviss, D.J. Martin, E.D. Weil.
- ↑ G. Anderegg, V. Gramlich: 1:1 Metal Complexes of Bivalent Cobalt, Nickel, Copper, Zink, and Cadmium with the Tripodal Ligand tris[2-(dimethylamino)ethyl]amine: Their stabilities and the X-ray crystal structure of its copper(II) complex sulfate. In: Helv. Chim. Acta. Band 77, Nr. 3, 1994, S. 685–690, doi:10.1022/hlca.19940770312.
- ↑ Patent EP0396999A2: 2-Methyl- und 2-Hydroxymethyl-serin-N,N-diessigsäure und ihre Derivate. Angemeldet am 30. April 1990, veröffentlicht am 14. November 1990, Anmelder: BASF AG, Erfinder: A. Oftring, S. Birnbach, R. Bauer, C. Gousetis, W. Trieselt.
- ↑ D.A. Smith, S. Sucheck, S. Cramer, D. Baker: Nitrilotriacetamide: Synthesis in concentrated sulfuric acid and stability in water. In: Synth. Commun. Band 25, Nr. 24, 1995, S. 4123–4132, doi:10.1080/00397919508011491.
- ↑ Patent GB1170399: A process for preparing 3,5-dioxo-1-piperazineacetamide and nitrilotriacetic acid triamide. Angemeldet am 12. Juni 1968, veröffentlicht am 12. November 1969, Anmelder: W.R. Grace & Co..
- ↑ D.A. Smith, S. Cramer, S. Sucheck, E. Skrzypzak-Jankun: Facile synthesis of substituted nitrilotriacetamides. In: Tetrahedron Lett. Band 33, Nr. 50, 1992, S. 7765–7768, doi:10.1016/0040-4039(93)88040-P.
- ↑ a b Patent US8362298B2: Hydrolyzed nitrilotriacetonitrile compositions, nitrilotriacetonitrile hydrolysis formulations and methods for making and using same. Angemeldet am 20. Mai 2011, veröffentlicht am 29. Januar 2013, Anmelder: Clearwater International, LLC, Erfinder: O.M. Falana, A. Hikem, S.R. Kakadjian, F. Zamora.
- ↑ Patent US4547589: Hydrolysis of nitrilotriacetonitrile. Angemeldet am 3. Januar 1984, veröffentlicht am 15. Oktober 1985, Anmelder: Monsanto Co., Erfinder: C.Y. Shen.
