Nitrosylfluorid
chemische Verbindung
Nitrosylfluorid ist eine chemische Verbindung aus der Gruppe der Nitrosylverbindungen und der Fluoride.
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
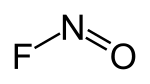
| |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Nitrosylfluorid | ||||||||||||||||||
| Andere Namen |
Stickstoffoxidfluorid | ||||||||||||||||||
| Summenformel | NOF | ||||||||||||||||||
| Kurzbeschreibung |
farbloses Gas[1] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 49,00 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
gasförmig[1] | ||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Siedepunkt | |||||||||||||||||||
| Dampfdruck | |||||||||||||||||||
| Löslichkeit |
Zersetzung bei Kontakt mit Wasser[2] | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | |||||||||||||||||||
Gewinnung und Darstellung
BearbeitenNitrosylfluorid kann durch folgende Reaktionen gewonnen werden:
- Reaktion von Nitrosyltetrafluoroborat mit Natriumfluorid im Vakuum bei 300 °C[1]
- Reaktion von Stickstoffmonoxid mit Fluor bei Raumtemperatur,[1] wobei Nitrosyltrifluorid als Nebenprodukt entsteht[4]
- Reaktion von Kaliumfluorid mit Stickstoffdioxid[2]
Eigenschaften
BearbeitenNitrosylfluorid ist ein farbloses Gas, das als Flüssigkeit durch Verunreinigungen oft bläulich gefärbt ist. In Wasser löst es sich mit blauer Farbe, geht dann aber rasch in Stickstoffmonoxid und Salpetersäure über. Es reagiert mit Glas heftig; Quarz ist aber beständiger.[1]
Einzelnachweise
Bearbeiten- ↑ a b c d e Georg Brauer (Hrsg.), unter Mitarbeit von Marianne Baudler u. a.: Handbuch der Präparativen Anorganischen Chemie. 3., umgearbeitete Auflage. Band I, Ferdinand Enke, Stuttgart 1975, ISBN 3-432-02328-6, S. 201.
- ↑ a b c d e f Charles T. Ratcliffe and Jean´ne M. Shreeve: Nitrosyl halides - A. Nitrosyl fluoride. In: William L. Jolly (Hrsg.): Inorganic Syntheses. Band 11. McGraw-Hill Book Company, Inc., 1968, S. 194–200 (englisch).
- ↑ Dieser Stoff wurde in Bezug auf seine Gefährlichkeit entweder noch nicht eingestuft oder eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- ↑ A. F. Holleman, E. Wiberg, N. Wiberg: Lehrbuch der Anorganischen Chemie. 101. Auflage. Walter de Gruyter, Berlin 1995, ISBN 3-11-012641-9, S. 711.