Nitrosylschwefelsäure
chemische Verbindung
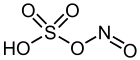
Nitrosylschwefelsäure ist eine chemische Verbindung mit der Formel (NO)HSO4. Das Salz ist eine Quelle des Nitrosylions (NO+) und gehört zur Gruppe der Hydrogensulfate.
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Nitrosylschwefelsäure | |||||||||||||||
| Andere Namen |
| |||||||||||||||
| Summenformel | NOHSO4 | |||||||||||||||
| Kurzbeschreibung |
farblose stechend riechende Kristalle[1] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 127,08 g·mol−1 | |||||||||||||||
| Aggregatzustand |
fest | |||||||||||||||
| Schmelzpunkt | ||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | ||||||||||||||||
Vorkommen
BearbeitenNitrosylschwefelsäure entsteht zum Beispiel bei der Reinigung von Abgasen (Rauchgas) aus der metallverarbeitenden Industrie, wenn Nassreinigungsverfahren mit Schwefelsäure eingesetzt werden.
Gewinnung und Darstellung
BearbeitenNitrosylschwefelsäure entsteht bei der Reaktion von Stickoxiden mit konzentrierter Schwefelsäure (z. B. als Nebenprodukt beim Bleikammerverfahren). Es kann auch durch Reaktion von Salpetriger Säure mit Schwefelsäure oder durch Einleiten von Schwefeldioxid in Salpetersäure gewonnen werden.[2]
Verwendung
BearbeitenNitrosylschwefelsäure wird verwendet:
- zur Herstellung von Caprolactam, Farbstoffen und Schädlingsbekämpfungsmitteln
- zur Diazotierung von Aminen (als Ersatz für Nitrosylschwefelsäure können dabei auch andere NO+ liefernde Verbindungen wie Nitrosyltetrafluoroborat [NO]BF4 oder Nitrosylchlorid benutzt werden).
Einzelnachweise
Bearbeiten- ↑ a b c d Eintrag zu Nitrosylschwefelsäure in der GESTIS-Stoffdatenbank des IFA, abgerufen am 9. Januar 2019. (JavaScript erforderlich)
- ↑ G. Brauer (Hrsg.), Handbook of Preparative Inorganic Chemistry 2nd ed., vol. 1, Academic Press 1963, S. 406.
