4-Hydroxybenzoesäure
4-Hydroxybenzoesäure ist eine chemische Verbindung aus der Gruppe der Hydroxybenzoesäuren. Es ist ein Abbauprodukt und Intermediat im Stoffwechsel der Chinone in Eukaryoten.
| Strukturformel | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
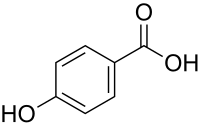
| ||||||||||||||||||||||
| Kristallsystem |
monoklin-prismatisch[1] | |||||||||||||||||||||
| Allgemeines | ||||||||||||||||||||||
| Name | 4-Hydroxybenzoesäure | |||||||||||||||||||||
| Andere Namen | ||||||||||||||||||||||
| Summenformel | C7H6O3 | |||||||||||||||||||||
| Kurzbeschreibung |
farb- und geruchloser, brennbarer Feststoff[4] | |||||||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Eigenschaften | ||||||||||||||||||||||
| Molare Masse | 138,12 g·mol−1 | |||||||||||||||||||||
| Aggregatzustand |
fest | |||||||||||||||||||||
| Dichte |
1,46 g·cm−3[5] | |||||||||||||||||||||
| Schmelzpunkt | ||||||||||||||||||||||
| Siedepunkt |
Zersetzung[4] | |||||||||||||||||||||
| pKS-Wert | ||||||||||||||||||||||
| Löslichkeit | ||||||||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Toxikologische Daten | ||||||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | ||||||||||||||||||||||
Die 4-Hydroxybenzoesäure (para-Hydroxybenzoesäure) wurde früher ebenfalls als Catalpinsäure bezeichnet, weil sie in den Blättern und Früchten (Schoten) der Trompetenbäume (Catalpa spp.) vorkommt.[9][10] Die Bezeichnung Catalpinsäure wird heute auf die in größeren Mengen im Samenöl von Arten (Catalpa spp. u. a.) der Trompetenbaumgewächse (Bignoniaceae) enthaltene Fettsäure bezogen. p-Hydroxybenzoesäure ist der Namensgeber für die Stoffgruppe der Parabene (para-Hydroxybenzoesäure).
Darstellung
Bearbeiten4-Hydroxybenzoesäure wird kommerziell aus Kaliumphenolat und Kohlendioxid in einer Kolbe-Schmitt-Reaktion hergestellt:[11]
Im Labor erfolgt die Herstellung durch Erhitzen von Kaliumsalicylat mit Kaliumcarbonat bis 240 °C, gefolgt von der Behandlung mit Säure (Salzsäure).
Biosynthese
Bearbeiten4-Hydroxybenzoesäure entsteht aus mehreren Stoffen: in Pflanzen aus seinem Addukt mit Coenzym A, das seinerseits aus 4-Cumaroyl-CoA entsteht; in Bakterien bei der Oxidation von Benzoesäure (EC 1.14.13.12) oder beim Abbau von Chorisminsäure (EC 4.1.3.40), 4-Methoxybenzoesäure (EC 1.14.99.15), 4-Hydroxybenzaldehyd (EC 1.2.1.64) oder 4-Chlorbenzoesäure (EC 3.8.1.6). Im Weiteren kann es zum Phenol decarboxyliert oder zur 3,4-Dihydroxybenzoesäure oxidiert werden. In der Biosynthese der Ubichinone wird es mit einem Polyprenylrest verknüpft.
Eigenschaften
BearbeitenDie wässrige Lösung von 4-Hydroxybenzoesäure reagiert sauer (pH-Wert: 3,3 bei einer Messtemperatur von 20 °C und einer Konzentration von 1 g/l).[4]
Verwendung
Bearbeiten4-Hydroxybenzoesäure wird technisch hauptsächlich zur Herstellung ihrer Ester verwendet, welche als Konservierungsmittel eingesetzt werden.
Gesundheitliche Gefahren
Bearbeiten4-Hydroxybenzoesäure wurde 2012 von der EU gemäß der Verordnung (EG) Nr. 1907/2006 (REACH) im Rahmen der Stoffbewertung in den fortlaufenden Aktionsplan der Gemeinschaft (CoRAP) aufgenommen. Hierbei werden die Auswirkungen des Stoffs auf die menschliche Gesundheit bzw. die Umwelt neu bewertet und ggf. Folgemaßnahmen eingeleitet. Ursächlich für die Aufnahme von 4-Hydroxybenzoesäure waren die Besorgnisse bezüglich Verbraucherverwendung und hoher (aggregierter) Tonnage sowie der Gefahren ausgehend von einer möglichen Zuordnung zur Gruppe der CMR-Stoffe und als potentieller endokriner Disruptor. Die Neubewertung fand ab 2014 statt und wurde von Tschechien durchgeführt. Anschließend wurde ein Abschlussbericht veröffentlicht.[12][13]
Weblinks
Bearbeiten- OECD: Screening Information Dataset (SIDS) Initial Assessment Report (SIAR) für Benzoic acid, 4-hydroxy-
Einzelnachweise
Bearbeiten- ↑ a b c d e Eintrag zu 4-Hydroxybenzoesäure. In: Römpp Online. Georg Thieme Verlag, abgerufen am 8. Dezember 2019.
- ↑ E. Winterstein, G. Trier: Die Alkaloide: eine Monographie der natürlichen Basen. Borntraeger, 1910, S. 305.
- ↑ Eintrag zu 4-HYDROXYBENZOIC ACID in der CosIng-Datenbank der EU-Kommission, abgerufen am 21. März 2020.
- ↑ a b c d e f g h i Eintrag zu 4-Hydroxybenzoesäure in der GESTIS-Stoffdatenbank des IFA, abgerufen am 8. Dezember 2019. (JavaScript erforderlich)
- ↑ a b Datenblatt 4-Hydroxybenzoesäure (PDF) bei Carl Roth, abgerufen am 1. Mai 2009.
- ↑ CRC Handbook of Tables for Organic Compound Identification. Third Edition, 1984, ISBN 0-8493-0303-6.
- ↑ C. A. Wachtmeister: Studies on the Chemistry of Lichens. X. The Structure of Porphyrilic Acid. In: Acta Chem. Scand. 10, 1956, S. 1404–1413, doi:10.3891/acta.chem.scand.10-1404, (PDF; 1,4 MB).
- ↑ David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press / Taylor and Francis, Boca Raton FL, Physical Constants of Organic Compounds, S. 3-288.
- ↑ Walter Karrer: Konstitution und Vorkommen der organischen Pflanzenstoffe. Springer, 1958, ISBN 978-3-0348-6795-5 (Reprint), S. 356.
- ↑ Y. P. S. Bajaj: Medicinal and Aromatic Plants VIII. Biotechnology in Agriculture and Forestry 33, Springer, 1995, ISBN 978-3-642-08201-6, S. 142 f.
- ↑ Autorengemeinschaft: Organikum. 19. Auflage, Johann Ambrosius Barth, Leipzig / Berlin / Heidelberg 1993, ISBN 978-3-335-00343-4, S. 351–352.
- ↑ Europäische Chemikalienagentur (ECHA): Substance Evaluation Report und Conclusion Document.
- ↑ Community Rolling Action Plan (CoRAP) der Europäischen Chemikalienagentur (ECHA): 4-hydroxybenzoic acid, abgerufen am 26. März 2019.

