Thallium(III)-chlorid
Thallium(III)-chlorid ist eine anorganische chemische Verbindung des Thalliums aus der Gruppe der Chloride.
| Kristallstruktur | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| ||||||||||||||||
| _ Tl3+ _ Cl− | ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Thallium(III)-chlorid | |||||||||||||||
| Andere Namen |
Thalliumtrichlorid | |||||||||||||||
| Verhältnisformel | TlCl3 | |||||||||||||||
| Kurzbeschreibung |
farbloser Feststoff (Tetrahydrat)[1] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 310,74 g·mol−1 | |||||||||||||||
| Aggregatzustand |
fest[1] | |||||||||||||||
| Dichte | ||||||||||||||||
| Schmelzpunkt | ||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | ||||||||||||||||
Gewinnung und Darstellung
BearbeitenThallium(III)-chlorid-tetrahydrat kann durch Reaktion von Thallium(I)-chlorid mit Chlor und Wasser gewonnen werden.[3]
Das Hydrat lässt sich nur schwierig entwässern, ohne dass dabei Zersetzung zu Thallium(I)-chlorid eintritt. Es gelingt mit Thionylchlorid oder Phosgen in Gegenwart von etwa Chlor bei Zimmertemperatur.[3]
Direkt kann die Verbindung durch Reaktion von Thallium mit Nitrosylchlorid gewonnen werden, wobei eine Komplexverbindung TlCl3·NOCl entsteht, die bei niedrigem Druck das Nitrosylchlorid verliert.[3]
Eigenschaften
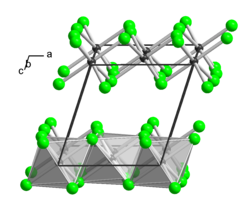
BearbeitenThallium(III)-chlorid ist ein sehr hygroskopischer Feststoff, der in Wasser, Ethanol und Ether sehr leicht löslich ist. Bei etwa 140 °C beginnt ein Sinterungsprozess und bei 155 °C beginnt Zersetzung unter Chlorabgabe. Er besitzt eine monokline Kristallstruktur isotyp zu der von Aluminium(III)-chlorid (a = 654 pm, b = 1133 pm, c = 632 pm, β=110° 12').[3]
Das Tetrahydrat ist ein farbloser Feststoff, dessen Kristalle an feuchter Luft zerfließen. Seine Lösung reagiert infolge Hydrolyse stark sauer, bei starkem Verdünnen fällt braunes Thallium(III)-oxid-hydrat aus. Die Verbindung ist auch in Ethylalkohol und Ether leicht löslich.[3]
Verwendung
BearbeitenLösungen von Thallium(III)-chlorid sind starke Oxidationsmittel und werden als solche in der organischen Chemie und Organometallchemie verwendet.[5]
Einzelnachweise
Bearbeiten- ↑ a b c d Datenblatt Thallium(III) chloride tetrahydrate, 98% bei Sigma-Aldrich, abgerufen am 29. März 2014 (PDF).
- ↑ a b William M. Haynes: CRC Handbook of Chemistry and Physics, 93rd Edition. CRC Press, 2012, ISBN 1-4398-8049-2, S. 4–94 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ a b c d e f g Georg Brauer (Hrsg.), unter Mitarbeit von Marianne Baudler u. a.: Handbuch der Präparativen Anorganischen Chemie. 3., umgearbeitete Auflage. Band I, Ferdinand Enke, Stuttgart 1975, ISBN 3-432-02328-6, S. 877.
- ↑ Nicht explizit in Verordnung (EG) Nr. 1272/2008 (CLP) gelistet, fällt aber mit der angegebenen Kennzeichnung unter den Gruppeneintrag Thalliumverbindungen mit Ausnahme der namentlich in diesem Anhang bezeichneten im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 14. November 2022. Hersteller bzw. Inverkehrbringer können die harmonisierte Einstufung und Kennzeichnung erweitern.
- ↑ A.J. Downs: Chemistry of Aluminium, Gallium, Indium, and Thallium. Springer, 1993, ISBN 0-7514-0103-X, S. 137 (eingeschränkte Vorschau in der Google-Buchsuche).


